Doble éxito para el silenciamiento génico del ARN de interferencia de la huntingtina
2 buenas noticias para el silenciamiento génico del ARN de interferencia en la EH: es seguro durante seis meses y hay una forma de tratar áreas cerebrales más grandes

La mayoría de los investigadores de la EH están muy entusiasmados con la idea de ‘silenciar’ el gen de la enfermedad de Huntington, para reducir la producción de la proteína huntingtina dañina. Dos desafíos, la seguridad y la administración, están ahora más cerca de resolverse gracias al trabajo colaborativo de investigadores académicos y de la industria.
Somos grandes admiradores del silenciamiento génico. Al igual que muchos investigadores de la enfermedad de Huntington, creemos que es el enfoque con más probabilidades de producir un tratamiento eficaz para la EH.
El silenciamiento génico implica el uso de un fármaco especialmente diseñado para interceptar una molécula mensajera, llamada ARN, que se produce a partir del gen de la EH e indica a las células que produzcan la proteína huntingtina dañina. El efecto del fármaco es que las células producen menos proteína.
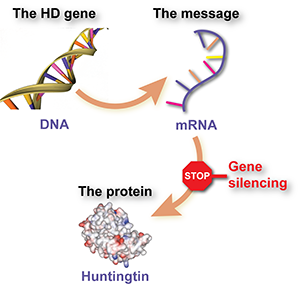
Dicho de forma aún más sencilla, el silenciamiento génico es como una señal de stop para la huntingtina mutante.
Progreso rápido
Hasta ahora, el silenciamiento génico para la EH, en sus diversas formas, ha superado todos los obstáculos que ha encontrado. Ahora se ha probado en varios modelos de ratón y rata de la EH, y no solo ha ralentizado la progresión, sino que en realidad ha producido una mejora tanto en los síntomas como en el daño cerebral. Parece que el cerebro puede recuperarse, hasta cierto punto, si solo se pueden reducir un poco los niveles de la proteína dañina.
Los obstáculos restantes
Varios equipos de investigación se dirigen a ensayos en humanos de silenciamiento génico en la EH. Pero quedan algunos desafíos por abordar antes de que eso pueda suceder.
El primero es la seguridad. Siempre son posibles los efectos secundarios inesperados, y podrían ser dramáticos, ya que estamos hablando de fármacos que se inyectan o infunden directamente en el sistema nervioso e interactúan directamente con la maquinaria genética de nuestras células.
Otro es la administración. Los fármacos de silenciamiento génico no se pueden administrar en forma de píldoras o inyecciones en la sangre, porque no se les permitiría entrar en el cerebro. Por lo tanto, deben introducirse directamente en el sistema nervioso. Dependiendo de la estructura del fármaco, esto significa una operación para introducir agujas o tubos en la columna vertebral o en el cráneo. Suena drástico, pero si el tratamiento es eficaz, valdrá la pena.
Sin embargo, el problema de la administración no termina ahí, porque una vez que el fármaco está en la cabeza, tiene que entrar dentro de nuestras células cerebrales para que funcione su magia genética.
El menú del silenciamiento génico
Los investigadores del silenciamiento génico tienen que tomar varias decisiones antes de comenzar un ensayo de tratamiento. Aquí hay una lista de verificación para ayudarle a comprender futuras noticias.
Primero, tenemos que decidir sobre la estructura del fármaco. Las dos opciones básicas son los fármacos de ARN de interferencia, que son químicamente similares a las moléculas mensajeras de ARN del cuerpo; y los fármacos ASO, que son ligeramente diferentes pero que las células pueden absorber mejor.
La segunda opción es qué objetivo elegir: ambas copias del gen de la EH, o solo la mutante. Dirigirse a ambas, lo que se denomina silenciamiento no específico, es más fácil, pero desactivar el gen ‘normal’ podría ser peligroso. Dirigirse solo al gen mutante, lo que se denomina silenciamiento alelo-específico, puede ser más seguro, pero es mucho más difícil de hacer.
La tercera opción es el destino: ¿a dónde irá el fármaco? Los fármacos de ARN de interferencia no se propagan de forma natural muy lejos, por lo que el fármaco debe administrarse directamente en la sustancia del cerebro. Los fármacos que se propagan más, como los ASO, podrían infundirse en el líquido que rodea el cerebro o, si tenemos suerte, en la base de la columna vertebral.
En cuarto lugar, debemos decidir sobre la administración. ¿Se administrará el fármaco solo, empaquetado en un virus o bombeado a presión, para aumentar su propagación por el cerebro?
La quinta opción es el régimen de tratamiento. ¿Deberíamos administrar un tratamiento único o infundir el fármaco durante semanas o meses? En este momento no sabemos cuánto durarán los efectos, por lo que esto debe resolverse comparando diferentes regímenes.
Siempre que lea sobre la investigación del silenciamiento génico, es útil averiguar de antemano qué opción se ha seleccionado para cada una de estas opciones.
Tres vienen todos a la vez
En el reciente Congreso Mundial de la EH en Melbourne, HDBuzz informó sobre presentaciones interesantes de varios grupos de investigación de silenciamiento génico. Luego, en noviembre, les trajimos noticias del primer ensayo de seguridad del silenciamiento génico de la huntingtina utilizando ARN de interferencia en el cerebro de un primate.
“El fármaco de ARN de interferencia se propagó más de lo que se obtendría con simples inyecciones. De hecho, mucho más lejos”.
Ahora, se han publicado dos artículos científicos más, cada uno fruto de la colaboración entre investigadores académicos y empresas de biotecnología. Ambos artículos involucraron a la empresa Medtronic, con sede en Minneapolis, y al equipo del Dr. Zheming Zhang en la Universidad de Kentucky.
Seguridad de seis meses
El informe de noviembre sobre la seguridad del ARN de interferencia en primates fue un estudio bastante corto: seis semanas. El nuevo estudio de Medtronic y el equipo de Zhang, publicado en la revista Brain, también se realizó en monos rhesus, pero duró seis meses completos.
Veamos lo que estudiaron los investigadores, utilizando la lista de verificación anterior:
-
Estructura: este fue un ensayo de un fármaco de ARN de interferencia.
-
Objetivo: ambas copias del gen fueron atacadas: silenciamiento no específico.
-
Destino: la sustancia del cerebro, el cuerpo estriado, para ser exactos, que se ve afectado al principio en los pacientes con EH.
-
Administración: el fármaco se empaquetó en un virus vacío, llamado AAV2.
-
Régimen de tratamiento: una inyección única en cinco sitios a cada lado del cerebro
También vale la pena señalar que se utilizaron monos ‘normales’, sin copias expandidas del gen de la EH. Por lo tanto, este ensayo solo pudo medir los cambios en las proteínas y la seguridad; no puede predecir la mejora en los pacientes.
Después del tratamiento, se observó a los monos durante seis meses, observando su salud general y el control del movimiento. La cirugía fue bien tolerada y no se observaron nuevos problemas en los animales tratados.
Como se esperaba, los niveles de proteína huntingtina disminuyeron significativamente en las regiones tratadas. En cada sitio de inyección, los niveles de proteína se redujeron en un área de unos seis milímetros de diámetro; en volumen, eso es aproximadamente el valor de tres M&M por cerebro. Puede que no parezca mucho, pero en un cerebro humano eso podría marcar una gran diferencia, y recuerde que estas mediciones se realizaron 6 meses después del tratamiento único.
Afortunadamente, el fármaco no causó cambios cerebrales dañinos como inflamación, infección o daño neuronal.
Por lo tanto, el fármaco hizo su trabajo de reducir los niveles de proteína, y el tratamiento no pareció producir ningún efecto dañino. Los autores calculan que seis meses de mono equivalen a unos 18 meses humanos. Suena bien, pero como señalan los autores, podría tomar incluso más tiempo en los humanos para que surjan efectos buenos o malos.
Un método de administración innovador
El otro nuevo artículo provino de una colaboración a tres bandas entre el equipo de la Universidad de Kentucky, Medtronic y la empresa de fármacos de ARN de interferencia Alnylam Pharmaceuticals. Se publicó en la revista Experimental Neurology.
Este también fue un estudio de ARN de interferencia de silenciamiento no específico, administrado en el cuerpo estriado de los monos.
Lo que distingue a este trabajo es el método de administración innovador. Se utilizó una técnica llamada administración mejorada por convección (CED). Esto implica colocar tubos a través del cráneo y dentro de la sustancia del cerebro. El extremo superior del tubo está conectado a una pequeña bomba que constantemente rocía el fármaco por el tubo a presión. Esta presión es la clave: hace que la molécula del fármaco se propague mucho más de lo que lo haría de otra manera.

La CED ya se utiliza para lograr que los fármacos de quimioterapia se propaguen más dentro de los tumores cerebrales. Pero, ¿funcionaría para administrar un fármaco de ARN de interferencia?
Primero, el fármaco se bombeó al cerebro durante siete días. Solo se trató un lado del cerebro, para que el otro pudiera usarse para la comparación. Se utilizó una variedad de dosis y tasas de infusión, para encontrar la mejor combinación. Luego, se probó una infusión de 28 días. Inteligentemente, el equipo realizó modificaciones radiactivas inofensivas al fármaco, que les permitieron medir exactamente hasta dónde se había propagado.
El fármaco hizo su trabajo de reducir los niveles de huntingtina, y los tubos y las infusiones no dañaron particularmente el cerebro.
Pero, ¿valió la pena la molestia adicional de colocar tubos y bombas? ¿Se propagó más el fármaco? En resumen, sí.
Las mediciones mostraron que el fármaco de ARN de interferencia llegó mucho más lejos de lo que cabría esperar con simples inyecciones. Si ambos lados del cerebro hubieran sido tratados, los niveles de huntingtina se habrían reducido en aproximadamente el valor de once M&M del cerebro.
En pocas palabras…
Antes de que salieran estos dos artículos, ya sabíamos que la huntingtina podía reducirse en el cerebro del mono utilizando ARN de interferencia. Ahora podemos agregar dos marcas de verificación importantes a nuestra lista de deseos: primero, el silenciamiento funciona y es seguro durante períodos más largos, y segundo, hay formas de lograr que el fármaco se propague más.
¿Qué podría salir mal?
El optimismo cauteloso es un enfoque sabio aquí. Ciertamente, hay algunas cosas que podrían salir mal en el camino hacia los ensayos en humanos, o durante ellos.
Estos ensayos en primates han demostrado que la reducción de los niveles de huntingtina es segura en monos sanos. Pero eso no significa que sea definitivamente seguro en pacientes humanos. Los cerebros humanos son mucho más grandes y complejos que los cerebros de los monos. Por lo tanto, el tratamiento podría ser menos eficaz o más peligroso, simplemente debido a la diferencia de especies.
También es posible que la proteína sana de alguna manera proteja al cerebro de su hermano dañino en los humanos. Si ese es el caso, silenciar ambas copias podría inesperadamente hacer más daño que bien.
Los cerebros de las personas con síntomas de EH son probablemente más frágiles y difíciles de operar también. Las partes del cerebro que necesitan tratamiento son más pequeñas de lo normal, debido a la contracción causada por la EH. Por lo tanto, las operaciones pueden ser más difíciles y más riesgosas.
Finalmente, detectar el éxito podría ser difícil en los humanos, porque la enfermedad progresa lentamente y no podemos examinar los cerebros de los pacientes bajo el microscopio.
Pero nunca olvide: todos estos problemas están siendo trabajados en conjunto por algunas de las mejores mentes científicas del mundo, todas enfocadas en hacer de los tratamientos efectivos una realidad para los pacientes.
2012: ¿el año del silenciamiento génico para la EH?
¿Podría 2012 ser el año del silenciamiento génico para los pacientes con EH? ¿Veremos uno o más ensayos en humanos en los próximos meses? Sobre la base del progreso hasta ahora, en realidad creemos que es algo razonable para esperar, y varios grupos están trabajando arduamente para hacerlo realidad. Los primeros ensayos serán pequeños y se llevarán a cabo lentamente y con gran precaución, porque la seguridad es la principal preocupación. Pero si todo va bien, seguirán ensayos más grandes.
Saber más
- Artículo en Brain sobre el tratamiento con ARN de interferencia durante 6 meses por Grondin y sus colegas (acceso abierto)
- Artículo en Experimental Neurology sobre la administración mejorada por convección de ARN de interferencia por Stiles y sus colegas (el artículo completo requiere pago o suscripción)
- Nuestro artículo sobre el ensayo de seguridad anterior en primates por la Dra. Beverly Davidson