
El silenciamiento del gen ASO llega más lejos y dura más
El silenciamiento del gen Huntingtin mediante fármacos ASO llega más lejos, dura más y es seguro. ¿Pronto ensayos en humanos?
Los fármacos llamados oligonucleótidos antisentido, u ASO, son una forma de silenciar el gen que causa la enfermedad de Huntington. Una nueva publicación en la revista Neuron sugiere que el silenciamiento del gen ASO llega más lejos en el cerebro que otros métodos, dura más y es seguro.
Hemos estado esperando con impaciencia los avances en el campo del silenciamiento génico, por lo que nos entusiasmó leer un nuevo e importante trabajo de investigación publicado hoy en la prestigiosa revista Neuron. Un grupo de investigadores, dirigido por el Dr. Don Cleveland de la Universidad de California en San Diego, en colaboración con las compañías farmacéuticas Isis pharmaceuticals, Genzyme y Novartis, han estado desarrollando
Repaso de genética

Crédito de la imagen: www.biocomicals.com de Alper Uzun, PhD
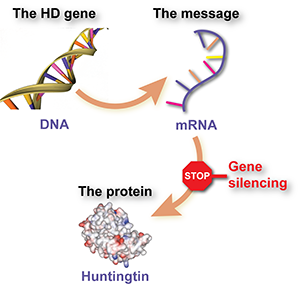
El gen de la enfermedad de Huntington es solo uno de los aproximadamente 25.000 pares de genes, compuestos de ADN, que contienen el código para la fabricación de proteínas; los bloques de construcción de las células, que forman nuestros cuerpos. Hay un par de pasos entre el ‘código’ del ADN y la proteína terminada. Uno de esos pasos implica el ARN mensajero, o ARNm.
El gen HD es el código que, cuando se traduce, produce ARNm HD. Es el ARNm el que le dice a una célula cómo fabricar la proteína huntingtina. Las personas que padecen la enfermedad de Huntington tienen una copia normal y una copia expandida del gen, por lo que también producen dos tipos diferentes de ARNm.
Desde que se identificó el gen HD, hace casi 20 años, los científicos han estado tratando de entender qué hace, cómo causa los síntomas de la EH y cómo desactivarlo eficazmente.
Desactivación del gen
Existen varios métodos posibles para desactivar el gen HD. Quizás el más conocido sea la interferencia de ARN, también conocida como ARNi o, a veces, siRNA.
Otro enfoque utiliza una molécula ligeramente diferente llamada oligonucleótidos antisentido, u ASOs.
Los ASO son un poco como un cruce entre el ADN y el ARNm. Son químicamente similares al ADN, pero están hechos de una sola cadena como el ARNm. Al igual que otros fármacos de silenciamiento génico, están diseñados para adherirse al ARNm HD y decirle a la célula que lo destruya, evitando así que se produzca la proteína huntingtina anormal.
La teoría detrás de esto es que si se evita que se produzca la proteína huntingtina anormal, se previenen sus efectos dañinos en las células y, por lo tanto, se reducen o retrasan los síntomas.
En los últimos meses, hemos escuchado buenas noticias de varios grupos que trabajan en fármacos de ARNi, pero hasta hace poco los investigadores de ASO no habían publicado tanto. Eso acaba de cambiar con esta última publicación, que nos pone al día con varios años de arduo trabajo.
Ya han comenzado los ensayos clínicos en humanos de ASO en otras enfermedades neurológicas, pero la situación en la EH se ha ralentizado por algunas preguntas sin respuesta.
El efecto de los ASO
En este nuevo trabajo, un grupo inteligente de investigadores ha analizado los efectos del uso de los ASO en 3 modelos de ratón diferentes de EH, y también en un modelo de mono (lo mejor después de los humanos en términos de modelos animales), para tratar de averiguar las respuestas a una serie de preguntas diferentes.
“Los ASO tratan partes del cerebro a las que otras técnicas de silenciamiento génico no han podido llegar”
En los monos, el fármaco se inyectó en el líquido cefalorraquídeo, un procedimiento mucho menos invasivo que inyectarlo en el cerebro, y uno que sería preferible para los pacientes humanos.
1. ¿Qué sucede cuando se infunde un ASO y cuánto dura?
Pues bien, infundieron los ASO en los ventrículos cerebrales (espacios llenos de líquido en el cerebro) durante dos o tres semanas. Esto condujo a una disminución de los niveles de la proteína huntingtina anormal en muchas áreas conocidas por ser importantes en el cerebro, incluido el cuerpo estriado, que es el más afectado en la enfermedad de Huntington. Los ASO pudieron extenderse mucho más en el cerebro de lo que hemos visto con los fármacos de ARNi.
Lo que es más, los niveles se mantuvieron bajos durante mucho tiempo: hasta tres meses después de detener la infusión.
2. ¿Qué pasó con los síntomas?
Los investigadores pueden controlar los síntomas de los modelos animales mediante pruebas que miden los movimientos y el comportamiento. Los animales tratados con ASO mejoraron en comparación con sus homólogos no tratados. Aún mejor, la mejora se mantuvo durante mucho tiempo, y no solo mientras los niveles de proteína permanecieron bajos. Los síntomas seguían siendo mejores algunos meses después de que los niveles de proteína huntingtina anormal hubieran vuelto a los niveles previos al tratamiento.
Esto apoya la idea de que el cerebro puede necesitar solo un poco de ayuda para sobrevivir a los efectos del gen HD. Un destacado investigador de la EH, Carl Johnson, acuñó el término ‘vacaciones de huntingtina’ para sugerir que un breve descanso de la proteína dañina puede ser todo lo que se necesita para inclinar la balanza a favor de la recuperación.
3. ¿Cuándo es el mejor momento para administrar el tratamiento?
Este estudio sugiere que el tratamiento temprano es probablemente mejor.
Los síntomas motores en un modelo de ratón en particular mejoraron al mes de tratamiento y continuaron mejorando hasta que los ratones HD no se diferenciaron de los ratones normales. Los síntomas conductuales se restablecieron a la normalidad a los 2 meses de tratamiento.
Cuando se trataron ratones más viejos con más síntomas, sus síntomas motores y conductuales mejoraron, pero tardaron mucho más en ser notables y no recuperaron tanto como los ratones más jóvenes y sanos.
4. ¿Qué sucede si se bloquea el ARNm HD ‘normal’?
Esta es una de las principales preguntas que nos impiden iniciar ensayos en la enfermedad de Huntington. Sabemos que la proteína huntingtina es esencial para el desarrollo temprano, ya que los embriones de ratón diseñados para no producir huntingtina mueren antes de nacer. ¿Es seguro desactivar la producción tanto de la proteína huntingtina normal como de la anormal en adultos?
Gracias a este trabajo, y al trabajo de otros investigadores del silenciamiento génico, nos estamos acercando a una respuesta. La desactivación del ARNm HD normal durante un máximo de 3 meses en monos sanos fue bien tolerada. En los modelos animales de EH, la desactivación tanto del ARNm normal como del anormal no cambió la cantidad de recuperación y no tuvo ningún efecto negativo.
El único posible punto conflictivo ahora es que los humanos pueden ser más sensibles a tener menos huntingtina que cualquier animal en el que podamos probar los fármacos. Solo un ensayo con pacientes nos lo dirá con seguridad.
Todo esto son buenas noticias
Ahora tenemos pruebas de que los ASO tratan partes del cerebro a las que otras técnicas de silenciamiento génico no han podido llegar. No solo eso, sino que una infusión a corto plazo con ASO fue suficiente para retrasar la progresión de los síntomas en los modelos animales de la enfermedad de Huntington. Y la reversión de los síntomas dura mucho más de lo esperado, incluso después de que los niveles de la proteína huntingtina anormal vuelvan a la normalidad.
¿Qué pasa después?
Sabemos que las personas que portan el gen HD expandido pueden permanecer perfectamente sanas durante muchos años, a pesar de producir la proteína huntingtina anormal desde el nacimiento.
Quizás un tratamiento único con ASO, o un tratamiento una vez al año, sea suficiente para ‘restablecer el reloj de la enfermedad’ bloqueando la producción de la proteína huntingtina durante el tiempo suficiente para permitir que las células eliminen la acumulación. La siguiente etapa en la investigación de este grupo será analizar cuánto durará una sola inyección de ASO.
Este trabajo también sugiere que la infusión en el líquido cefalorraquídeo podría ser suficiente para los fármacos ASO. Eso no es un paseo por el parque, pero es relativamente sencillo en comparación con la colocación de tubos y bombas para introducir los fármacos directamente en el cerebro.
También necesitamos averiguar cuánto ASO se necesitará para producir un efecto en los humanos, cuándo y durante cuánto tiempo debe administrarse, y estar preparados para los efectos secundarios inesperados.
Pero parece que nos estamos acercando cada vez más a los ensayos de silenciamiento génico de la EH en humanos. Y con varios grupos diferentes al borde de los ensayos, y ansiosos por ser los primeros en probar su fármaco en pacientes, es un momento realmente emocionante para el silenciamiento génico en la EH.


