Una proteína de reparación del ADN modifica la estabilidad de los tramos largos de CAG en el gen de la enfermedad de Huntington
La reparación del ADN es un proceso fundamental para las células, pero los errores en este proceso podrían explicar la ‘inestabilidad de repetición’ en la EH
La proteína MSH3 desempeña una función importante en las células, buscando y ayudando a reparar errores genéticos y ADN dañado. Sin embargo, un nuevo estudio de científicos de la Universidad de Toronto, Hospital for Sick Children, sugiere que la MSH3 puede ayudar a la progresión de la enfermedad de Huntington al aumentar la inestabilidad de la repetición de CAG en el cerebro.
El problema de la inestabilidad genética
La causa básica de la enfermedad de Huntington está bien establecida. Un segmento repetido de tres bloques de construcción del código genético Citosina-Adenosina-Guanina (o, más simplemente, ‘C-A-G’) cerca del comienzo del gen de la EH es excesivamente largo en las personas que desarrollan la enfermedad.
La repetición de CAG muestra una gran diversidad en toda la población, incluso en individuos no afectados. Las longitudes de repetición normales pueden oscilar entre 6 y 36, mientras que las repeticiones superiores a 40 conducen invariablemente a la enfermedad de Huntington.
Pero la longitud de la repetición de CAG tiene otras propiedades predictivas. El número de repeticiones no solo puede determinar si una persona desarrollará o no la enfermedad de Huntington, sino que también puede predecir aproximadamente la edad a la que pueden comenzar a surgir los síntomas de la enfermedad. Cuanto mayor sea la longitud de la repetición, antes comenzará la EH, en promedio.
En las familias que portan la mutación, la EH a veces muestra ‘anticipación’, una forma técnica de decir que el inicio de la enfermedad puede ser más temprano con cada generación sucesiva. Los científicos han descubierto que esta anticipación puede explicarse por un evento biológico llamado ‘inestabilidad genética’.
La inestabilidad se refiere a una tendencia de los tramos repetitivos de ADN a crecer a lo largo de la vida de un individuo. Esto puede causar, por ejemplo, que la región C-A-G en el gen de la EH se alargue.
Por razones que no se comprenden, la inestabilidad genética ocurre con más frecuencia en algunos tejidos y tipos de células que en otros. Por ejemplo, aunque las longitudes de repetición son bastante estables en la sangre (donde se recolectan muestras para las pruebas genéticas de la EH), a menudo se expanden en las células espermáticas.
Esta inestabilidad genética explica por qué se produce la anticipación en la EH. Las repeticiones tienden a alargarse, lo que provoca que los hijos tengan un inicio más temprano que sus padres, en promedio. Debido a que esta expansión es especialmente común en las células espermáticas, las expansiones son más probables en los genes de la EH heredados de los padres que de las madres.
Los efectos intergeneracionales de la inestabilidad genética se conocen desde hace bastante tiempo. Sin embargo, estudios más recientes están arrojando luz sobre cómo también puede afectar el pronóstico de la enfermedad en pacientes individuales.
Inestabilidad en el cerebro
El daño cerebral en la enfermedad de Huntington tiene un patrón específico: no todas las partes del cerebro se degeneran en la misma medida. Las partes del cerebro que son más vulnerables a morir en la EH se denominan cuerpo estriado y corteza cerebral. Curiosamente, los científicos han descubierto que estas regiones del cerebro son también las áreas que muestran los niveles más significativos de inestabilidad de repetición.
Dado que la longitud de la repetición está tan estrechamente asociada con la edad de inicio de la EH, el alargamiento de la repetición de CAG dentro de estas regiones del cerebro podría posiblemente explicar por qué se pierden selectivamente en la enfermedad. Para apoyar aún más esta idea, los pacientes con EH que muestran el daño cerebral más grave son los que tienen los niveles más altos de inestabilidad de la repetición de CAG.
Estos hallazgos plantean una pregunta importante. ¿Por qué algunos pacientes con EH tienen niveles más altos de inestabilidad genética en el cerebro? ¿Qué problema surge primero, un mayor daño cerebral causa una mayor inestabilidad, o la inestabilidad causa un peor daño cerebral?
En un intento de abordar este problema de frente, un equipo dirigido por el Dr. Christopher Pearson en el Hospital for Sick Children en Toronto buscó genes que pudieran controlar las diferencias en la inestabilidad genética de una persona a otra. En esta búsqueda, un gen, llamado MSH3, surgió como el principal contendiente.
“Desafortunadamente, un subproducto del proceso de reparación es que se pueden introducir erróneamente repeticiones de CAG adicionales en la secuencia. Como un deslizamiento de tierra, cuantas más repeticiones se agreguen, mayor será el problema original. Esta es la raíz de la inestabilidad genética”.
La evidencia
Para buscar genes que pudieran controlar la inestabilidad genética, los investigadores agregaron un fragmento pequeño pero tóxico del gen de la enfermedad de Huntington en dos cepas diferentes de ratones. Las diferentes cepas de ratones son como personas de diferentes familias o diferentes razas de perros; aunque todos son ratones, tienen distintos antecedentes genéticos.
Los investigadores descubrieron que la inestabilidad del gen de la enfermedad de Huntington ocurría en una cepa de ratones (llamada B6), pero no en la otra (llamada CBy). A partir de investigaciones previas sobre inestabilidad genética, realizadas por el laboratorio de Pearson y otros, los investigadores sospecharon que la dramática diferencia entre los ratones podría reducirse a variaciones en un proceso biológico particular, llamado reparación de errores de emparejamiento, y más específicamente a uno de sus principales actores, la proteína MSH3.
Para probar si las diferencias genéticas en MSH3 estaban causando la alteración en la inestabilidad de la repetición, los científicos transfirieron el gen MSH3 de ratones CBy (que anteriormente no mostraban expansión de la repetición de CAG) a la cepa B6, y viceversa.
Los resultados fueron dramáticos. Al intercambiar los genes entre las cepas de ratones se produjo una inversión completa de la inestabilidad de la repetición. Los ratones CBy, que anteriormente habían sido inmunes a los aumentos en la longitud de la repetición, ahora eran la cepa con los niveles más altos, mientras que la cepa B6 mostró poca inestabilidad de la repetición. ¡El efecto siguió al gen MSH3!
Para determinar qué podría estar causando la discrepancia, los investigadores analizaron las secuencias genéticas del gen MSH3 de ambas cepas de ratones. Dentro de la cepa CBy, se identificó una sola mutación que se encontró que tenía un efecto significativo en la función de MSH3. Esta única mutación provocó que la proteína MSH3 se volviera inestable y la célula la degradara rápidamente. Como resultado, cualquier MSH3 producido por las células se descompondría y reciclaría rápidamente, lo que reduciría sustancialmente sus niveles generales.
Estos hallazgos sugirieron dos cosas: que si una persona portara naturalmente una mutación similar en su gen MSH3, también podría tener una menor inestabilidad de la repetición de CAG y, por lo tanto, un mejor pronóstico de la enfermedad, y en segundo lugar, que la creación de fármacos para atacar MSH3 podría ser valiosa para el tratamiento de la enfermedad de Huntington, asumiendo que la inestabilidad es importante.
Reparación de errores de emparejamiento y la proteína MSH3
Entonces, ¿qué hace exactamente MSH3 y cómo podría afectar el pronóstico de la enfermedad de Huntington? Para explicar esto mejor, necesitamos aprender un poco sobre ese proceso biológico tan importante mencionado anteriormente, la reparación de errores de emparejamiento del ADN.
La reparación del ADN, en general, es un proceso necesario que permite a nuestras células corregir errores o mutaciones que surgen dentro de nuestro código genético. Estas mutaciones pueden ser causadas por múltiples eventos, algunos de las actividades celulares normales y otros de daños ambientales, como la luz ultravioleta o los productos químicos. Algunos insultos genéticos pueden causar roturas en el ADN, mientras que otros introducen mutaciones únicas: cambios en la secuencia de letras en el ADN.
Las proteínas de reparación de errores de emparejamiento, como MSH2, MSH3 y MSH6, buscan dos tipos diferentes de errores genéticos: ‘errores de emparejamiento’ que ocurren cuando el ADN se está copiando en células que se están dividiendo y pequeños bucles que pueden formarse dentro del ADN después de una rotura de una sola hebra.
Las repeticiones de CAG que causan la EH son particularmente susceptibles a la formación de estos pequeños bucles de ADN. La razón está relacionada con las propiedades fundamentales del ADN que hacen posible que se copie dentro de la célula.
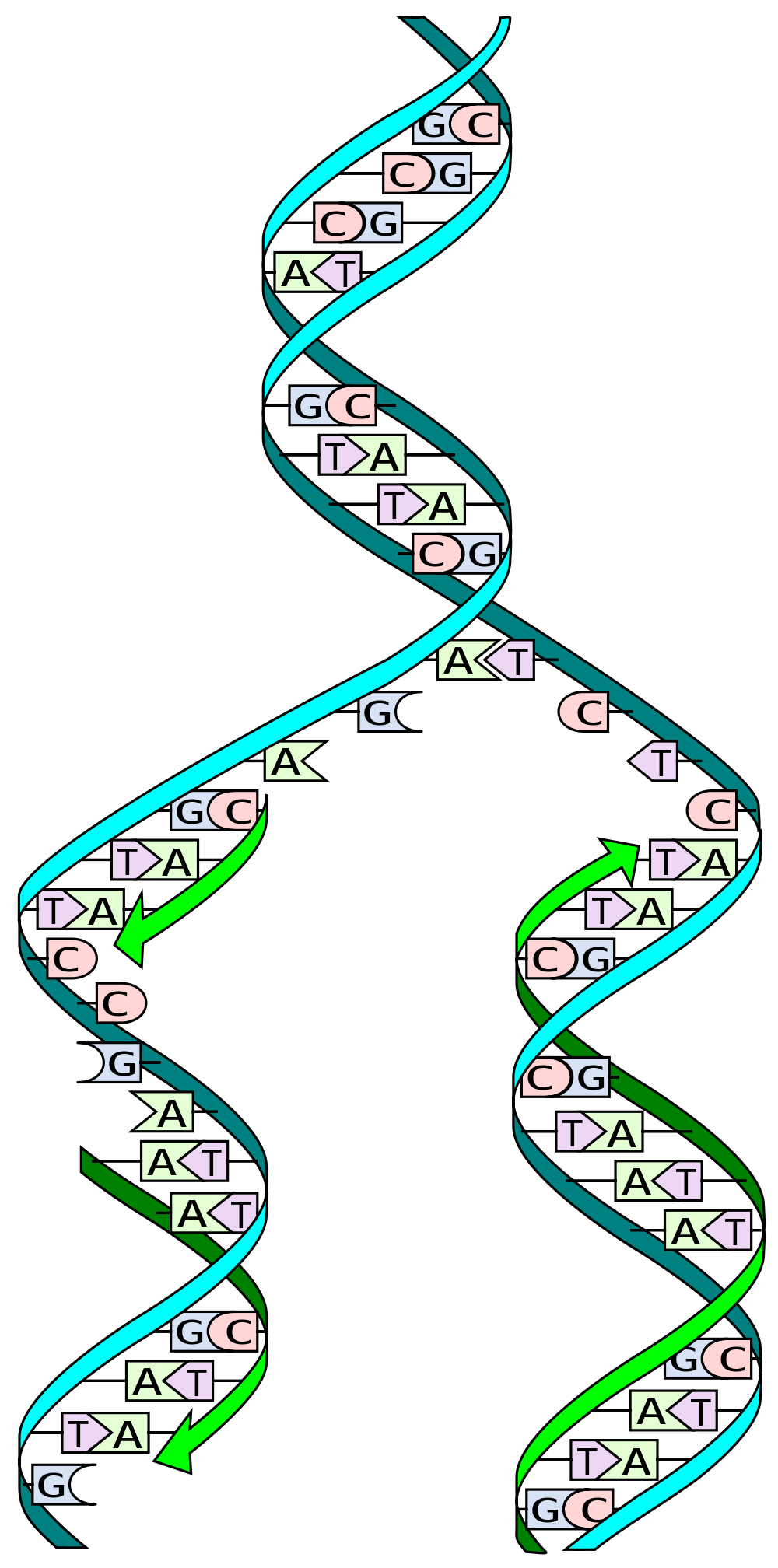
Crédito de la imagen: Madeleine Price Ball
Mucha gente ha oído que el ADN es una ‘doble hélice’. Esto básicamente significa que está formado por dos hebras que forman una estructura enrollada. Estas hebras de ADN a menudo se describen como copias entre sí, o una imagen especular, pero esto es solo parcialmente cierto.
El ADN está formado por solo 4 bloques de construcción genéticos diferentes llamados nucleótidos, que se denominan citosina (C), guanina (G), adenosina (A) y timidina (T). C tiene una afinidad natural por G, mientras que A se siente atraído por T.
Cuando se replica el ADN, la doble hélice se separa en dos hebras individuales. Máquinas moleculares especializadas, llamadas ‘polimerasas’, luego leen el código genético, una letra a la vez, generando una nueva segunda hebra y, a su vez, una nueva copia del ADN.
Para hacer esto, las polimerasas explotan las afinidades naturales de los nucleótidos. Por ejemplo, cuando la maquinaria alcanza una C en la secuencia genética, recluta una G en la hebra de ADN en crecimiento, y cuando detecta una T, la empareja con una A. Esta es la razón por la que decimos que las dos hebras de ADN no son exactamente una copia entre sí. Proporcionan la información para hacer la segunda hebra, pero no son una réplica.
Ahora, volvamos a las repeticiones de CAG. Cuando una hebra de ADN se rompe cerca o dentro de una repetición de CAG larga, puede liberar esa hebra para formar un bucle debido a la afinidad natural de C y G dentro de su secuencia.
Dos proteínas de reparación de errores de emparejamiento, MSH2 y MSH3, se unen para buscar y reparar este tipo de bucles de ADN. Desafortunadamente, un subproducto del proceso de reparación es que se pueden introducir erróneamente repeticiones de CAG adicionales en la secuencia. Como un deslizamiento de tierra, cuantas más repeticiones se agreguen, mayor será el problema original. Esta es la raíz de la inestabilidad genética.
Entonces, ¿qué está sucediendo exactamente en los ratones CBy que los hace resistentes a la expansión de la repetición? Recuerde, los investigadores encontraron que los ratones CBy tenían una mutación en la secuencia genética de MSH3 que causaba que la proteína se volviera inestable. Con menos MSH3 disponible para encontrar y corregir bucles de ADN dentro de la repetición de CAG del gen de la EH (posiblemente introduciendo CAG adicionales en el proceso), la inestabilidad genética se detuvo.
¿Qué sigue?
¿Qué significa todo esto para los pacientes con la enfermedad de Huntington? En este momento, todo lo que sugiere es que una de las razones por las que existe variación en la edad de inicio entre las personas con longitudes de repetición iguales podría ser debido a la capacidad variable de sus proteínas MSH3 para reparar estos bucles de ADN. Si hubiera personas que portaran una mutación similar a la identificada en los ratones, podrían tener una progresión de la enfermedad retrasada.
En teoría, el estudio también sugiere que si pudiéramos modificar la actividad de la proteína MSH3 en pacientes con EH, podríamos modificar la cantidad de inestabilidad de la repetición en su gen de la EH. Si la inestabilidad de la repetición es importante para el desarrollo de la EH, esto podría teóricamente ralentizar el desarrollo de la enfermedad.
Sin embargo, el desafío de atacar MSH3 es que la reparación del ADN es un proceso importante para todas las células del cuerpo. Si las mutaciones en los genes no se pueden corregir de manera eficiente, tienen el potencial de acumularse y causar cáncer. Queda por ver si la interrupción de la actividad de MSH3 podría tolerarse lo suficiente como para prevenir el inicio de la EH, sin causar otras enfermedades graves.
Este estudio no hace promesas sobre el potencial terapéutico de la investigación, pero ciertamente han creado interés en el seguimiento de MSH3 en pacientes. Cuanto más sepamos sobre los diferentes genes que pueden afectar la enfermedad de Huntington, mejor se podrá utilizar la información para brindar una mejor atención al paciente a través de un pronóstico de la enfermedad más preciso.