
¿Una ‘bisagra oxidada’ causa la enfermedad de Huntington?
Científicos canadienses han descubierto que la proteína huntingtina mutante es menos flexible de lo normal.

Descifrar cómo la proteína huntingtina mutante causa daño es el problema central de la investigación de la enfermedad de Huntington. Ahora, un equipo de investigadores canadienses liderado por el Dr. Ray Truant ha demostrado que la proteína tiene una importante función de ‘bisagra’, que funciona peor en las células con la mutación de la EH. ¡Es emocionante, pero, al contrario de lo que pueda haber leído, no significa que ya no necesitemos estudiar ratones!
Huntingtina
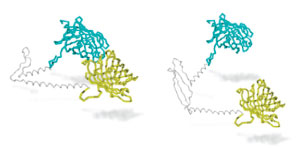
Crédito de la imagen: Caron et al, PNAS 2013
Una gran ventaja para los investigadores que estudian la enfermedad de Huntington es que, a diferencia de muchas otras enfermedades cerebrales, sabemos exactamente qué la causa. Una mutación en un solo gen indica a las células que produzcan una proteína dañina:
En los 20 años transcurridos desde su descubrimiento, hemos descubierto mucho sobre lo que hace normalmente la proteína huntingtina y lo que falla cuando se produce su gemelo tóxico, la huntingtina mutante.
Estudiar la huntingtina es crucial para nuestros esfuerzos por desarrollar tratamientos para la EH, porque averiguar cómo y por qué la huntingtina mutante causa daño es un paso importante para prevenir ese daño.
Demasiadas glutaminas
Las proteínas están hechas de largas cadenas de bloques de construcción, llamados aminoácidos. Estos están conectados como una cadena de cuentas, y el orden exacto de los aminoácidos determina la forma y el comportamiento de la proteína.
Un pequeño cambio en el orden de los aminoácidos puede causar un gran cambio en la forma de una proteína, y eso puede alterar drásticamente cómo hace su trabajo en las células, o incluso hacerla venenosa.
La huntingtina mutante es diferente de la proteína ‘normal’ en una sola cosa: cerca del principio de la cadena, la proteína huntingtina tiene una secuencia donde un bloque de construcción, la glutamina, se repite varias veces. El número habitual de glutaminas está entre diez y veinte.
La enfermedad de Huntington ocurre cuando hay demasiadas glutaminas.
¿Cuál es el número mágico?
Entonces, ¿cuántas glutaminas se necesitan antes de que la proteína huntingtina empiece a causar daño? Curiosamente, la respuesta es treinta y siete. Por debajo de esto, la proteína huntingtina no causa la enfermedad de Huntington por lo que sabemos. Por encima de esto, la EH es inevitable, siempre y cuando una persona viva lo suficiente.
¿Por qué demonios cambiarían las cosas con 37 glutaminas? ¡No lo sabemos! Pero desentrañar este misterio es una de las principales prioridades para los investigadores de la EH.
Aún más extraño, mientras que la mayoría de las personas con la enfermedad de Huntington tienen entre 40 y 60 glutaminas, ese número de glutaminas adicionales no produce la enfermedad en otros animales, como los ratones. Los modelos animales de la EH necesitan tener más de cien glutaminas en su proteína huntingtina antes de que empecemos a ver los síntomas.
Este es otro misterio, y uno que sugiere que la huntingtina causa problemas químicos sutiles pero muy importantes en los humanos, que nuestros modelos animales no pueden detectar.
¿Qué pasa con el CAG?
“Las células humanas podrían utilizarse para identificar fármacos que ayuden a que la bisagra funcione, pero aún tendrán que probarse en animales, incluidos ratones”
De dónde vienen estas glutaminas adicionales, puede que se esté preguntando. La respuesta está en el gen de la EH, que es una receta o un conjunto de instrucciones para fabricar la proteína huntingtina. Al igual que la proteína tiene muchas glutaminas cerca del principio, el gen tiene un tramo donde las ‘letras’ químicas C-A-G se repiten. El número de repeticiones de ‘CAG’ en el gen corresponde al número de bloques de construcción de glutamina en la proteína. Y si hay demasiados CAG en el gen, habrá demasiadas glutaminas en la proteína huntingtina.
¿Qué hay de nuevo?
El profesor Ray Truant, su estudiante Nick Caron y el equipo de Truant en la Universidad McMaster en Canadá acaban de publicar un artículo en la revista PNAS, que describe su trabajo para estudiar cómo el número de glutaminas afecta a la proteína huntingtina. Por primera vez, han encontrado un cambio potencialmente importante que ocurre alrededor del número crítico de 37 glutaminas.
Los tramos de proteína a ambos lados de todas esas glutaminas son trozos llamados las regiones ‘corriente arriba’ y ‘corriente abajo’. Investigaciones anteriores han sugerido que cada una de ellas desempeña un papel en dar a la proteína mutante sus propiedades dañinas.
Lo que hizo el equipo de Truant fue preguntar si las regiones corriente arriba y corriente abajo podrían estar trabajando juntas, con el trozo de glutamina en medio actuando como una bisagra. También se preguntaron si su ‘bisagra’ podría no funcionar correctamente en la proteína mutante.
Es hora de una analogía de El Señor de los Anillos
Para investigar esto, necesitaban una forma de averiguar si las regiones corriente arriba y corriente abajo terminaban lo suficientemente cerca como para trabajar juntas. Utilizaron un tipo inteligente de ‘sensor de proximidad’ llamado FLIM-FRET.
¿Recuerda la espada de Frodo ‘Sting’ en las películas de El Señor de los Anillos, y cómo brilla azul cuando los orcos están cerca? FLIM-FRET es algo parecido a eso.
Los investigadores pegaron accesorios especiales sensibles a la luz en la proteína huntingtina, uno en la región corriente arriba y otro en las regiones corriente abajo. Estos no hacen nada a menos que la proteína se pliegue, uniendo las dos regiones. Cuando eso ocurre, la luz pasa de una etiqueta a la otra, brilla (como la espada de Frodo) y puede medirse.
La bisagra oxidada de la EH
El sensor de proximidad tipo Sting de Truant demostró que las regiones corriente arriba y corriente abajo sí terminan plegadas juntas en las células, con el tramo de glutamina actuando como una bisagra. Además, brillaba menos cuando había 37 o más glutaminas en la huntingtina, lo que sugiere que los problemas con la bisagra comienzan alrededor de este número. Truant llama a esto la ‘hipótesis de la bisagra oxidada’ y sugiere que es una forma en que la proteína mutante podría causar daño.
El equipo de Truant confirmó estos hallazgos utilizando proteínas de varias longitudes diferentes y, en última instancia, mostró la misma anomalía en las células de la piel tomadas directamente de un paciente con la enfermedad de Huntington.
Atándolo
¿Cómo encaja esta idea de la ‘bisagra oxidada’ con otras cosas que ya sabemos sobre la huntingtina mutante?

Bueno, sabemos que otra proteína llamada PACSIN puede adherirse a la región corriente abajo de la huntingtina. Aquí, el equipo de Truant demostró que también puede adherirse a la región corriente arriba, lo que sugiere que podría ser capaz de mantener las dos regiones juntas a través de la bisagra de glutamina, como un mecanismo de cierre de la puerta.
Cuando PACSIN se eliminó artificialmente, el sensor de proximidad brilló menos, lo que sugiere que las regiones corriente arriba y corriente abajo se habían separado. Cambiar el comportamiento de PACSIN podría superar el problema de la bisagra, un posible nuevo enfoque para pensar en el tratamiento de la enfermedad de Huntington.
El otro vínculo con nuestra comprensión existente proviene de pequeños cambios químicos que las células hacen a las proteínas. Estas ‘etiquetas’ químicas pueden cambiar cómo se comportan las proteínas y dónde terminan. El equipo de Truant había demostrado previamente que las etiquetas ‘fosfo’ son importantes para determinar a dónde va la proteína huntingtina y lo dañina que es.
En su último trabajo, demostraron que estas etiquetas fosfo también pueden tener un efecto en la actividad de la bisagra de glutamina. Esto proporciona un mayor apoyo a la idea de que los fármacos para controlar el etiquetado fosfo podrían ser capaces de prevenir algunos efectos dañinos de la proteína mutante.
Lo que muestra esta investigación
El equipo de Truant ha hecho un trabajo realmente bueno, inventando un sensor de proximidad (o tomando prestado uno de Frodo Bolsón) y utilizándolo para demostrar que la región crucial de la glutamina de la huntingtina, el trozo que es demasiado largo en la EH, funciona como una bisagra, permitiendo que las regiones corriente arriba y corriente abajo trabajen juntas.
Mientras tanto, otra proteína, PACSIN, abarca la bisagra y las une. Y han vinculado la función de la bisagra al etiquetado fosfo de la huntingtina. Además, esta propiedad de la bisagra parece empezar a fallar con aproximadamente el mismo número de glutaminas que causan la enfermedad en pacientes humanos.
No solo es esta nueva información sobre la proteína huntingtina, y cómo causa daño. También nos da nuevas ideas de posibles tratamientos, cambiando el comportamiento de PACSIN1 o la maquinaria que controla el etiquetado fosfo.
Lo que no muestra
Este no sería un artículo de HDBuzz sin una nota de precaución. En este caso, creemos que es importante destacar algunas de las cosas que la investigación no nos dice, al contrario de lo que pueda haber leído en línea.
CBC News informó de que el trabajo «evita la necesidad de ensayos con ratones», porque los hallazgos de Truant pudieron verse en células humanas. Desafortunadamente, eso no es cierto. Las células humanas podrían utilizarse para identificar rápidamente fármacos que ayuden a que la ‘bisagra’ funcione mejor, pero esos fármacos aún tendrán que probarse en animales, incluidos ratones. Para vencer a la EH, necesitaremos toda la ayuda que podamos conseguir. Ningún modelo animal individual es perfecto para desarrollar fármacos, pero tampoco lo son las células humanas que crecen en una placa, o incluso los pacientes humanos por sí solos. Los diferentes sistemas de modelos contribuyen cada uno con información útil para ayudarnos a progresar.
Otra cosa que este trabajo no nos da es una comprensión completa de cómo el problema de la bisagra hace que la proteína huntingtina se vuelva dañina. Muchas veces en la investigación, detrás de cada puerta encontramos otra puerta, que requiere más trabajo para abrir. El equipo de Truant y otros trabajarán ahora en la comprensión del panorama más amplio de cómo el problema de la bisagra de la huntingtina afecta al funcionamiento de la célula y el cerebro. Y convertir estos hallazgos en tratamientos que puedan ser tomados por los pacientes requerirá aún más trabajo. Así que, ¡seguimos adelante!


