“Ver” la proteína huntingtina tóxica en personas con EH
Nuevas herramientas nos permiten “ver” acumulaciones de proteína huntingtina tóxica que se acumulan en el cerebro de las personas con la enfermedad de Huntington con el tiempo. El seguimiento de estas acumulaciones podría ayudarnos a comprender mejor cómo progresa la EH o cómo los tratamientos podrían ralentizar o detener la EH.

Los científicos han desarrollado una herramienta que nos permite “ver” las acumulaciones tóxicas de la proteína huntingtina utilizando escáneres especiales. Las personas con la enfermedad de Huntington (EH) producen una forma tóxica de la proteína huntingtina que forma acumulaciones en las células de sus cuerpos, que se acumulan durante la progresión de la EH. El seguimiento de cómo se forman estas acumulaciones con el tiempo en personas con EH, o cómo cambian cuando las personas con EH toman diferentes tratamientos, podría ayudarnos a comprender mejor la progresión de la EH y qué medicamentos ayudan más a los pacientes.
¿Qué son estas acumulaciones de proteínas?
Todos tenemos 2 copias del gen de la huntingtina, pero para las personas que tienen la enfermedad de Huntington (EH), una de sus copias tiene un tipo de mutación llamada expansión de repetición. Esta mutación se produce en un fragmento repetitivo del código de ADN del gen de la huntingtina que tiene las letras “C”, “A” y “G” que se repiten una y otra vez. Si no tiene EH, tendrá menos de ~35 repeticiones CAG en su gen de la huntingtina, pero para las personas con EH, la mutación significa que tendrán más de 35 repeticiones CAG en uno de sus genes de la huntingtina.
El gen de la huntingtina es la receta que nuestras células utilizan para producir la proteína huntingtina, por lo que si se cambia el código de ADN de esta receta, la proteína que producen nuestros cuerpos también se cambiará. Las proteínas están hechas de largas cadenas de productos químicos llamados aminoácidos, siguiendo las instrucciones establecidas en nuestro ADN. Las letras de ADN “CAG” son las notas de la receta para el aminoácido glutamina. Esto significa que si el número de repeticiones de CAG aumenta, la proteína huntingtina tendrá muchas más glutaminas repetidas. Las moléculas de proteína huntingtina con demasiadas glutaminas no pueden ensamblarse correctamente, por lo que pueden formar acumulaciones tóxicas.
Conocemos estas acumulaciones desde hace mucho tiempo y se pueden ver en los cerebros de las personas con EH cuando miramos bajo un microscopio. Sin embargo, el seguimiento de estas acumulaciones en pacientes vivos ha sido un desafío y la mayor parte de nuestro conocimiento sobre ellas proviene de observarlas en muestras de cerebro post-mortem de modelos animales de EH o de pacientes que han donado generosamente sus cerebros a la investigación.
¿Por qué queremos observar estas molestas acumulaciones?
Científicos de muchos laboratorios del Reino Unido, Alemania, Italia, Suecia y los EE. UU. han desarrollado herramientas moleculares que ahora nos permiten “ver” estas acumulaciones en animales vivos y, con suerte, pronto, en pacientes con EH. Estas herramientas se unen a las acumulaciones de proteína huntingtina y tienen decoraciones químicas, llamadas radioetiquetas, lo que significa que se iluminan cuando se observan mediante una exploración PET (tomografía por emisión de positrones).
Este tipo de herramientas moleculares se conocen como trazadores PET y se utilizan en muchos entornos médicos y de diagnóstico diferentes para permitir a los médicos e investigadores obtener imágenes de partes específicas de su cuerpo. Se pueden tragar, inyectar o inhalar diferentes tipos de trazadores según la parte de su cuerpo que se esté observando. Una vez que el paciente tiene el trazador PET en su cuerpo, se le escaneará y la parte del cuerpo que se esté observando se iluminará si el objetivo del trazador PET está allí porque el trazador es ligeramente radiactivo. Se han desarrollado herramientas similares para estudiar otras enfermedades, como el compuesto B de Pittsburgh, que se utiliza para observar acumulaciones similares en personas con Alzheimer.
La creación de trazadores PET que permitan a los investigadores ver las acumulaciones tóxicas de proteína huntingtina es una idea atractiva por varias razones. En primer lugar, se puede realizar una exploración PET en pacientes en múltiples momentos a lo largo de su vida, por lo que podemos rastrear cómo se acumulan las acumulaciones con el tiempo a lo largo de la progresión de la EH. Muchos de nuestros métodos actuales para observar las acumulaciones de huntingtina en el cerebro del paciente solo se pueden realizar actualmente al final de la enfermedad en el tejido post-mortem.
En segundo lugar, las exploraciones PET son procedimientos no invasivos y nos permiten mirar directamente en el cerebro, mientras que los procedimientos más intrusivos, como la medición de la proteína huntingtina en el líquido cefalorraquídeo, solo proporcionan un indicador de lo que creemos que está sucediendo en el cerebro. En tercer lugar, las acumulaciones se forman a partir de la forma tóxica de la proteína huntingtina, por lo que las exploraciones PET permitirán a los investigadores medir específicamente los cambios en esta forma específica de huntingtina mutante. Esto difiere de la mayoría de las formas en que medimos y analizamos la huntingtina en el líquido cefalorraquídeo o la sangre, que miden todas las diferentes formas de huntingtina, incluida la proteína huntingtina sana.
Desarrollo del primer ligando PET de huntingtina
En agosto pasado, se publicó una versión temprana de estas herramientas llamada CHDI-180R: ¡la primera vez que se ha creado un trazador PET para la proteína huntingtina! Un equipo dirigido por Celia Domínguez en la Fundación CHDI demostró que la molécula de la herramienta CHDI-180R era capaz de unirse muy estrechamente a las acumulaciones de proteína huntingtina tóxica en un tubo de ensayo. También utilizaron CHDI-180R para mostrar dónde estaban las acumulaciones de huntingtina tóxica en muestras de cerebro de modelos de ratón con EH.
En los cerebros de ratones con la mutación de la EH, se pudieron ver acumulaciones de la proteína huntingtina tóxica en muchas regiones diferentes del cerebro que se sabe que están afectadas por la EH, mientras que en los ratones sin la mutación de la EH, estas acumulaciones no se pudieron ver, a pesar de que también se les había inyectado la molécula de la herramienta CHDI-180R. Finalmente, los científicos demostraron que CHDI-180R se extendió bien por el cerebro y también fue seguro sin efectos secundarios tanto en monos como en ratas.
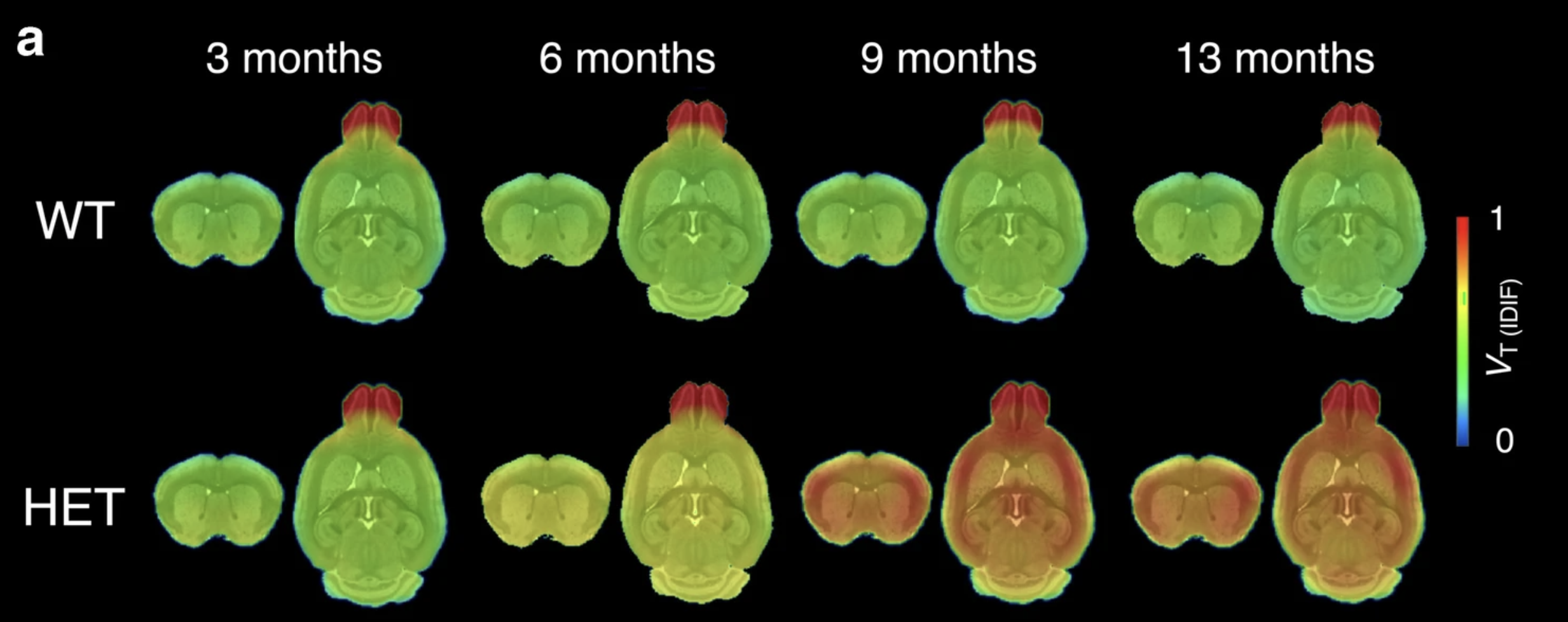
Crédito de la imagen: Bertoglio et al (2021) Eur J Nucl Med Mol Imaging
Ajuste fino de las herramientas
El desarrollo de trazadores PET a menudo requiere múltiples intentos antes de que se encuentre una herramienta óptima, por lo que el mismo grupo internacional de científicos también está desarrollando otras versiones de este trazador para tener muchas opciones de respaldo. Estas versiones (con suerte) nuevas y mejoradas de la herramienta molecular se están probando para determinar cómo se propagan en los cerebros de los animales probados.
Otras enfermedades como el Alzheimer también tienen acumulaciones de proteínas que se acumulan en las células nerviosas, pero estas están formadas por otras proteínas potencialmente tóxicas, como el beta amiloide. Los científicos también están comprobando cuán específicas son estas herramientas para las acumulaciones de proteína huntingtina que se acumulan con el tiempo en pacientes con EH en comparación con otras acumulaciones de proteínas de enfermedades, como las de pacientes con Alzheimer. Hasta ahora, los resultados han sido muy alentadores, por lo que los científicos ahora están ansiosos por comenzar a probar los trazadores en personas.
Entonces, ¿qué sigue?
Se está llevando a cabo un ensayo clínico llamado estudio iMagemHTT, que investigará el trazador de huntingtina en personas. El ensayo utilizará imágenes PET/MRI para comprender cómo el ligando PET rastrea la huntingtina en el cerebro. Anteriormente informamos sobre algunos datos preliminares alentadores del
La cantidad de acumulaciones de huntingtina en los cerebros de las personas con EH es un buen biomarcador de la progresión de la enfermedad. Los biomarcadores son mediciones objetivas que los científicos y los médicos pueden tomar para rastrear la progresión de la EH, lo que puede ser importante para determinar las mejores opciones de tratamiento, así como si los tratamientos están funcionando correctamente. Es posible que los pacientes con EH en el futuro puedan ser monitoreados mediante una exploración PET utilizando este tipo de herramientas.
Si los ligandos PET funcionan como esperan los científicos, también podrían usarse para rastrear la reducción de huntingtina en el cerebro en futuros ensayos. A pesar de algunos contratiempos, la reducción de huntingtina sigue siendo una estrategia prometedora para tratar la EH, que está siendo llevada a cabo por Novartis, PTC Therapeutics, Wave y Uniqure, todos los cuales tienen ensayos clínicos en curso. Independientemente de lo que suceda con la reducción de huntingtina, estas nuevas y emocionantes herramientas están dando a los científicos la capacidad, por primera vez, de rastrear la proteína huntingtina mutante en todo el cerebro de pacientes vivos con EH, lo cual es un gran avance.
¡Esperamos poder informarles más sobre este tema pronto!
Saber más
- Visualización de agregados de huntingtina mutante: Desarrollo de un posible ligando PET (acceso abierto)
- [11C]CHDI-626, un trazador PET candidato para la visualización de agregados de huntingtina mutante con unión reducida a proteínas patológicas de la EA (acceso abierto)
- Evaluación preclínica longitudinal del nuevo radioligando [11C]CHDI-626 para la imagen PET de agregados de huntingtina mutante en la enfermedad de Huntington (acceso abierto)
- Caracterización farmacológica de candidatos a trazadores de imagen PET dirigidos a agregados de huntingtina mutante (acceso abierto)