
Silenciamiento génico para la EH: la historia hasta ahora
¿Es el silenciamiento génico tan prometedor como parece para la EH, y qué podría deparar el futuro?

Precaución: Traducción automática – Posibilidad de errores
Para difundir lo antes posible las noticias sobre la investigación de la EH y las actualizaciones de los ensayos al mayor número de personas posible, este artículo ha sido traducido automáticamente por IA y aún no ha sido revisado por un editor humano. Aunque nos esforzamos por ofrecer información precisa y accesible, las traducciones de la IA pueden contener errores gramaticales, interpretaciones erróneas o frases poco claras.Para obtener la información más fiable, consulta la versión original en inglés o vuelve más tarde para ver la traducción totalmente editada por humanos. Si detectas problemas importantes o si eres hablante nativo de este idioma y te gustaría ayudar a mejorar la precisión de las traducciones, no dudes en ponerte en contacto con nosotros en editors@hdbuzz.net.
El silenciamiento génico consiste en utilizar moléculas especialmente diseñadas para ‘desactivar’ el mensaje que hace que las células produzcan la proteína huntingtina dañina. Nuestro manual de HDBuzz sobre el silenciamiento génico explica las técnicas, los resultados obtenidos hasta ahora y los retos que se avecinan.
Hemos recibido muchas peticiones de los lectores para que escribamos un artículo sobre el ‘silenciamiento génico’, también conocido como ‘silenciamiento de la huntingtina’. Es un área de investigación que genera mucho entusiasmo. La atención de muchas personas se ha centrado en este tema gracias al reciente comunicado de prensa conjunto de Lundbeck y la Universidad de Massachusetts, en el que se anuncia una colaboración de investigación destinada a desarrollar terapias de ‘interferencia de ARN (ARNi)’ para la EH.
Entonces, ¿qué es el silenciamiento génico? ¿Cómo funciona y cómo podría beneficiar a los pacientes con EH?

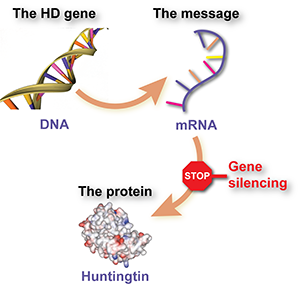
Genes, mensajes y proteínas
Las proteínas son moléculas que actúan como pequeñas máquinas, llevando a cabo la mayor parte del trabajo útil dentro de las células: cosas como hacer que las reacciones químicas funcionen, comunicar mensajes, dar a las células su estructura, etc. Cada proteína diferente se fabrica utilizando un conjunto de instrucciones llamado gen. Los genes están hechos de ADN y viven en el centro de control de la célula, el núcleo.
Sin embargo, los genes no se utilizan para fabricar proteínas directamente. En medio, la célula utiliza la secuencia de ADN del gen como plantilla para fabricar una ‘molécula mensajera’ llamada ‘ARN mensajero’ o ARNm. La molécula mensajera de ARNm se utiliza entonces para decirle a la célula qué bloques de construcción debe unir para fabricar la proteína.
Para recapitular, el ADN se utiliza como plantilla para fabricar un mensaje de ARNm, y la molécula mensajera se utiliza entonces para construir moléculas de proteína.
La enfermedad de Huntington está causada por un único gen anormal: el gen que indica a las células que produzcan la proteína llamada huntingtina. Cada célula tiene dos copias de cada gen. La mayoría de las personas con EH, o que la desarrollarán más adelante, tienen un gen ‘normal’ y otro con demasiadas repeticiones de la secuencia de tres letras ‘CAG’ cerca del principio. Ese simple ‘error ortográfico’ da como resultado una proteína ‘mutante’ que se comporta de forma diferente a la proteína normal, dañando las células y produciendo los síntomas de la EH.
Es posible que haya oído el término ‘tipo salvaje‘: así es como los científicos llaman al gen y a la proteína no mutantes, o ‘normales’.
Silenciar el gen de la huntingtina
Dado que el gen anormal es la causa de todos los problemas en la EH, ¿por qué no deshacerse de él y sustituirlo por un gen sano? Desafortunadamente, es poco probable que eso funcione, porque las células tienen formas muy seguras de proteger el ADN para evitar daños o alteraciones.
La molécula mensajera de ARNm, por otro lado, está flotando en la célula, y mientras esté ahí, seguirá utilizándose para fabricar más moléculas de proteína. Si de alguna manera pudiéramos decirle a la célula que ignore ese mensaje, la proteína dañina no se fabricaría. Ese es el razonamiento detrás del ‘
El silenciamiento génico suena demasiado bueno para ser verdad, pero no lo es. En 1998, dos investigadores, que ganaron el Premio Nobel de Medicina, descubrieron cómo desactivar genes individuales. Llamaron a su técnica interferencia de ARN (ARNi).
El silenciamiento génico es ahora una técnica estándar utilizada por los científicos para estudiar cómo funcionan los organismos, cómo las enfermedades causan daños y como una forma de desarrollar tratamientos. Un fármaco de silenciamiento génico (Vitravene, utilizado para tratar una infección viral del ojo) está autorizado para su uso en humanos, y hay más de una docena de ensayos en curso en muchas enfermedades diferentes, y hay más en camino.
Si fuera tan fácil como eso, ya tendríamos píldoras de silenciamiento génico para la enfermedad de Huntington, así que, ¿cuál es el problema? Bueno, como con cualquier nueva técnica, seguramente habrá desafíos, contratiempos y obstáculos inesperados en el camino.
Primer desafío: entrar en el cerebro
Uno de los principales problemas es conseguir que las moléculas de silenciamiento lleguen a donde se necesitan. En la EH, la muerte de las células cerebrales llamadas neuronas es el principal problema, por lo que necesitamos que la molécula entre en esas células.
“Varios grupos diferentes de investigadores han informado ahora del éxito en la reducción de la producción de huntingtina en modelos animales”
El primer obstáculo es conseguir que el fármaco entre en el cerebro. El cerebro tiene un escudo defensivo natural para evitar que sustancias nocivas entren en él desde la sangre. Eso es bueno para nosotros en general, porque protege el cerebro, pero les da un dolor de cabeza a los investigadores de fármacos para la EH, porque hace que sea mucho más difícil conseguir que los fármacos entren en el cerebro que en, digamos, el hígado o los riñones.
Así que es poco probable que una simple tableta o inyección sea adecuada para luchar contra la EH con el silenciamiento génico. Una forma de evitar este problema es utilizar bombas y pequeños tubos para infundir el fármaco de silenciamiento directamente en el cerebro o en el líquido que lo rodea: el líquido cefalorraquídeo o LCR. Eso suena bastante desalentador, y no hay duda de que implantar bombas o tubos en el sistema nervioso es un gran problema, pero en realidad ya se utilizan sistemas similares para administrar fármacos en otras enfermedades como la esclerosis múltiple (EM) y el cáncer cerebral, donde tienen un muy buen historial de seguridad.
Segundo desafío: distribución
Una vez que el fármaco está en el sistema nervioso, el problema de la distribución aún no está resuelto. El cerebro es una bola densa de tejido a través de la cual es difícil que se propaguen las moléculas de silenciamiento. Además, el tratamiento necesita entrar dentro de las células para funcionar: flotar entre las células no es suficiente.
Los científicos están utilizando diferentes métodos para solucionar este problema. Los ganadores del Premio Nobel utilizaron moléculas de interferencia de ARN (ARNi) para desactivar los genes. Son muy similares a las moléculas producidas naturalmente por las células. La desventaja es que no tienden a propagarse naturalmente a través del cerebro, y no son terriblemente buenas para entrar en las células.
Por lo tanto, los investigadores de ARNi tienden a utilizar tubos muy finos, insertados en la sustancia del cerebro, dirigidos a las regiones más afectadas, conectados a bombas que utilizan la presión para propagar el fármaco más lejos. Otra opción es dejar que las moléculas de ARNi ‘se enganchen’ dentro de virus desactivados, que son expertos en propagarse por el cerebro e inyectar cosas en las células.
Otro enfoque es probar diferentes moléculas que podrían ser mejores para propagarse y entrar en las células. Los oligonucleótidos antisentido (ASOs) son similares a las moléculas de ARNi, pero son ligeramente más simples y no son producidos naturalmente por las células. El principio es el mismo: se adhieren a la molécula mensajera de ARNm y evitan que la célula la utilice para construir proteínas.
Los ASO parecen ser mucho mejores para propagarse por todo el cerebro y pueden entrar en las células con bastante facilidad. También parecen durar mucho más, lo que podría ser bueno o malo, dependiendo de lo bien que hagan su trabajo.
¿Qué técnica de silenciamiento génico es mejor? Simplemente no lo sabemos, por lo que se está trabajando en el ARNi y los ASO al mismo tiempo, para ver cuál es el mejor.
Tercer desafío: desactivar el gen
La prueba clave de un tratamiento de silenciamiento génico es si puede desactivar el gen con éxito. Hasta ahora, la investigación en modelos animales de EH ha sugerido fuertemente que esto se puede lograr, tanto con los tratamientos de ARNi como con los de ASO.
En 2005, un equipo de investigadores dirigido por Bev Davidson en Iowa inyectó moléculas de ARNi en los cerebros de ratones con EH, y logró una reducción del 85% en el mensaje de la huntingtina. La función motora y las anomalías celulares de los ratones también mejoraron. Desde entonces, varios grupos diferentes de investigadores han informado del éxito en la reducción de la producción de huntingtina utilizando varias moléculas diferentes, incluyendo fármacos de ARNi y ASO. El trabajo más reciente sugiere que los beneficios incluso de las infusiones cortas se mantienen durante períodos bastante largos.
Cuarto desafío: elegir el objetivo correcto
A los investigadores de fármacos les gusta detectar los problemas por adelantado en lugar de esperar a que sucedan, y un posible problema con el silenciamiento génico son sus efectos en la copia natural o de tipo salvaje del gen de la huntingtina.
Sabemos que no tener nada de huntingtina es peligroso. Los ratones sin ninguna de las dos copias del gen mueren antes de nacer. Así que la pregunta clave es, ¿la reducción de la huntingtina mutante que se necesita para tratar la enfermedad causa una reducción de la huntingtina de tipo salvaje que es peligrosa?
Por el momento no lo sabemos. Algunos investigadores creen que sólo pequeñas reducciones de la huntingtina mutante serán suficientes para dar a las células la oportunidad de recuperarse, por lo que no tenemos que preocuparnos por los efectos nocivos de la reducción de la proteína de tipo salvaje ligeramente. Otros creen que necesitamos desarrollar tratamientos que desactiven sólo la proteína mutante. Eso se llama silenciamiento alelo-específico: un alelo es lo que llamamos a cada una de las dos copias de un gen.
El silenciamiento alelo-específico suena muy sensato: si podemos dirigirnos al gen mutante, ¿por qué no lo haríamos? La desventaja es que para dirigirnos a una sola copia de un gen, tenemos que buscar en el ADN de cada paciente las diferencias individuales de ‘ortografía’ entre los dos alelos. Afortunadamente, tales diferencias son comunes, pero probablemente todavía necesitaríamos varios fármacos diferentes para poder proporcionar un tratamiento dirigido al mayor número posible de pacientes. Algunos pacientes no tienen ninguna diferencia de ortografía adecuada que pueda ser objeto de este tipo de tratamiento.
El debate sobre si el silenciamiento alelo-específico es necesario está en curso, pero la buena noticia es que no tendremos que esperar más para obtener una respuesta, porque ambas técnicas están siendo probadas ahora mismo por diferentes grupos de investigadores.
Quinto desafío: efectos secundarios
Los tratamientos de silenciamiento génico podrían seguir teniendo efectos secundarios, incluso si se pueden evitar los posibles problemas de la reducción de la huntingtina de tipo salvaje.
Un problema son los llamados ‘efectos fuera del objetivo’, en los que la molécula del fármaco se adhiere e interfiere con las moléculas mensajeras de genes distintos de la huntingtina. Eso podría producir cualquier número de problemas.
Otro problema es que el sistema inmunitario del cerebro podría acabar luchando contra las moléculas ‘extrañas’ que se están bombeando en él, y eso podría empeorar las cosas.
Tenemos que tomar en serio estos posibles efectos secundarios ahora, mientras todavía estamos en la etapa de probarlos en animales. Incluso los efectos indeseados bastante leves podrían ser malas noticias, especialmente si el silenciamiento génico termina siendo utilizado durante muchos años para prevenir los síntomas en personas que han tenido una prueba positiva.
Los científicos están trabajando para producir las mejores moléculas con el menor riesgo de efectos secundarios graves, y sólo las más seguras se presentarán para los ensayos en humanos.
¿Cuándo, cuándo, cuándo?
El entusiasmo por el silenciamiento génico está justificado, porque muchos investigadores creen que es nuestra mejor oportunidad para producir tratamientos exitosos para la EH. Claramente hay muchos problemas que resolver, pero con cada año que pasa se están haciendo progresos, y todo el mundo está de acuerdo en que no se ha encontrado nada hasta ahora que sugiera que la técnica no funcionará en los pacientes.
En este momento se está llevando a cabo un ensayo de silenciamiento génico con ASO en pacientes con ELA (enfermedad de la neurona motora). Eso es realmente importante porque está probando no sólo el fármaco, sino también el sistema de administración de bomba y tubo para llevar el fármaco a donde se necesita. Mientras tanto, muchos investigadores de todo el mundo están averiguando qué moléculas serán las mejores para probar en pacientes con EH.
No podemos decir con seguridad cuándo estarán disponibles los tratamientos de silenciamiento génico para los pacientes, pero HDBuzz se sentiría decepcionado si no vemos ensayos en humanos de silenciamiento génico para la EH en un futuro muy próximo.


