
Reorientación de la proteína huntingtina dentro de las células
Un equipo canadiense descodifica las etiquetas que reorientan la proteína huntingtina dentro de las células, lo que ayuda a explicar cómo se vuelve tóxica

Precaución: Traducción automática – Posibilidad de errores
Para difundir lo antes posible las noticias sobre la investigación de la EH y las actualizaciones de los ensayos al mayor número de personas posible, este artículo ha sido traducido automáticamente por IA y aún no ha sido revisado por un editor humano. Aunque nos esforzamos por ofrecer información precisa y accesible, las traducciones de la IA pueden contener errores gramaticales, interpretaciones erróneas o frases poco claras.Para obtener la información más fiable, consulta la versión original en inglés o vuelve más tarde para ver la traducción totalmente editada por humanos. Si detectas problemas importantes o si eres hablante nativo de este idioma y te gustaría ayudar a mejorar la precisión de las traducciones, no dudes en ponerte en contacto con nosotros en editors@hdbuzz.net.
La proteína huntingtina mutante causa la enfermedad de Huntington, pero no toda la huntingtina mutante es igualmente tóxica. El lugar exacto donde se encuentra dentro de las células tiene un gran impacto en si las células pueden lidiar con la proteína mutante. Una nueva investigación está ayudando a comprender las señales que mueven la huntingtina mutante alrededor de la célula, proporcionando pistas sobre cómo hacerla menos tóxica.
Huntingtina: y su gemelo malvado
Aunque la enfermedad de Huntington se debe a una anomalía genética, sabemos que el daño que causa a las células se debe a la proteína huntingtina mutante. El gen de la EH es un conjunto de instrucciones para fabricar la proteína huntingtina. En las personas con EH, y en aquellas que están destinadas a desarrollar la enfermedad, un ‘error ortográfico’, al principio de las instrucciones genéticas, hace que un fragmento particular de la proteína sea más largo de lo normal. Demasiados bloques de construcción llamados ‘glutamina’ están pegados en un extremo de la proteína.

Tener demasiados bloques de glutamina al principio de la proteína tiene efectos desastrosos, y es lo que hay que culpar de los efectos nocivos de la huntingtina mutante.
Una de las principales tareas de los investigadores de la enfermedad de Huntington es averiguar exactamente en qué se diferencia la proteína mutante de la normal, y cómo esas diferencias hacen que dañe las células. Cada nueva información sobre las formas en que la proteína causa daño, es una posible pista en la búsqueda de tratamientos para ralentizar la enfermedad.
Ray Truant es un investigador de la enfermedad de Huntington en la Universidad McMaster en Ontario, Canadá. Truant y su equipo de científicos han estado estudiando la proteína huntingtina durante muchos años y han compartido muchas ideas importantes sobre cómo funciona, y cómo sale mal en la enfermedad de Huntington.
El fragmento N-terminal
La huntingtina es una proteína grande, por lo que estudiarla toda a la vez es difícil. Después de que el gen fuera descubierto en 1993, pronto se descubrió que el fragmento más dañino de la proteína mutante está cerca del principio. Los científicos llaman a este fragmento de huntingtina, que contiene las glutaminas adicionales, ‘el fragmento N-terminal’.
Además de la región crítica que está mutada en la EH, este fragmento N-terminal de la proteína huntingtina tiene una serie de otras características interesantes. Los científicos lo han estado estudiando durante casi 20 años y todavía están encontrando una serie de propiedades inesperadas de este corto trozo de proteína – propiedades que tienen un gran impacto en las células.
Gestión de equipaje en las células
El laboratorio de Truant ya había descubierto que los diecisiete primeros bloques de construcción de aminoácidos de la huntingtina parecen ser particularmente importantes. Se comportan un poco como una ‘etiqueta de dirección’ para toda la proteína.
Dependiendo de lo que le esté sucediendo a una célula, pequeñas ‘etiquetas’ químicas pueden adherirse a los diecisiete primeros aminoácidos, o ser eliminadas. La maquinaria de transporte de la célula puede entonces leer estas etiquetas como un código de barras. Dependiendo del patrón de etiquetas presentes, la proteína huntingtina se mueve a diferentes lugares de la célula. Así, a pesar de que estos diecisiete aminoácidos son sólo una pequeña porción de toda la proteína huntingtina, pueden tener un gran impacto en la ubicación y la función de la proteína.
El proceso de añadir y eliminar estas pequeñas etiquetas se llama ‘modificación postraduccional’. La ‘traducción’ es el proceso de construcción de proteínas utilizando las instrucciones del ADN en nuestros genes, por lo que ‘postraduccional’ significa simplemente ‘después de que la proteína ha sido construida’.
Los números mágicos: trece y dieciséis
“Etiquetas específicas en los aminoácidos decimotercero y decimosexto de la huntingtina ayudan a determinar si termina o no en el núcleo”.
La comprensión de la modificación postraduccional es realmente importante en la EH, porque parece influir en lo dañina que es la proteína. Por ejemplo, en 2009, el grupo de William Yang en la UCLA descubrió que la adición de dos de estas etiquetas impedía que los ratones modelo de la EH mostraran síntomas. Esas etiquetas se adjuntaron a los bloques de construcción de aminoácidos decimotercero y decimosexto de la proteína huntingtina.
Dado que esas dos etiquetas químicas parecen cruciales para lo tóxica que es la proteína huntingtina mutante, es importante entenderlas con más detalle. El equipo de Truant se propuso averiguar el efecto de esas dos etiquetas en el lugar donde terminaba la proteína, y cuánto daño hacía una vez que estaba allí.
¿Qué averiguaron?
En primer lugar, los investigadores estudiaron la proteína en células vivas, creciendo en una placa en el laboratorio. Alteraron las células genéticamente para que sólo produjeran los diecisiete primeros bloques de aminoácidos de la proteína huntingtina, que llamaron N17. El fragmento de huntingtina N17 se unió a una proteína de medusa que brilla de color amarillo. Eso permite que el fragmento N17 sea observado mientras se mueve dentro de las células.
El equipo de Truant descubrió que cuando el fragmento corto de huntingtina era etiquetado en los puntos críticos decimotercero y decimosexto, era mucho más probable que terminara en el núcleo de las células.
El núcleo es una parte realmente importante de la célula: es donde se almacena, copia y lee el ADN. Muchos investigadores han sugerido que la huntingtina es más tóxica para las células cuando llega al núcleo. Pero también puede hacer daño cuando está fuera del núcleo, por lo que es importante averiguar dónde es más peligrosa.
El equipo fue más allá, mostrando que la huntingtina se encuentra en lugares muy específicos dentro del núcleo. También desarrollaron nuevas técnicas para observar sólo las versiones etiquetadas de la proteína, en lugar de todas las copias sin etiquetar que flotan alrededor. Estas herramientas serán muy útiles para futuros estudios que investiguen el papel que desempeña este proceso de etiquetado en la EH.
¿Qué pasa con los fármacos?
Este trabajo muestra que etiquetas específicas en los aminoácidos decimotercero y decimosexto de la huntingtina ayudan a determinar si termina o no en el núcleo. Esto lleva a la idea de que los fármacos que alteran el etiquetado de esos aminoácidos podrían ser capaces de reducir el daño a las células.
¿Cómo funcionaría un fármaco así? O, en el lenguaje de los cazadores de fármacos, ¿cuál sería su ‘objetivo’?
Bueno, las etiquetas químicas se unen a la huntingtina mediante máquinas de proteínas llamadas ‘quinasas’. Y son eliminadas por otras máquinas llamadas ‘fosfatasas’. Las quinasas son un poco como grapadoras, mientras que las fosfatasas son más como quitagrapas.
Según el trabajo de Truant, los fármacos que reducen la actividad de la ‘grapadora’ quinasa deberían reducir las etiquetas en la huntingtina, manteniéndola fuera del núcleo. El siguiente paso sería ver dónde termina la proteína, y si eso la hace más o menos tóxica.
Para probar este enfoque, el equipo de Truant utilizó muchos fármacos diferentes que se sabe que se dirigen a las quinasas. Estos productos químicos ‘inhibidores de la quinasa’ pueden ayudar a los científicos a descubrir qué quinasa en particular podría estar etiquetando su proteína favorita. Al bloquear una quinasa en particular, y luego utilizar las nuevas herramientas que han desarrollado para buscar la huntingtina etiquetada, los investigadores pueden descubrir qué quinasas están haciendo el etiquetado.
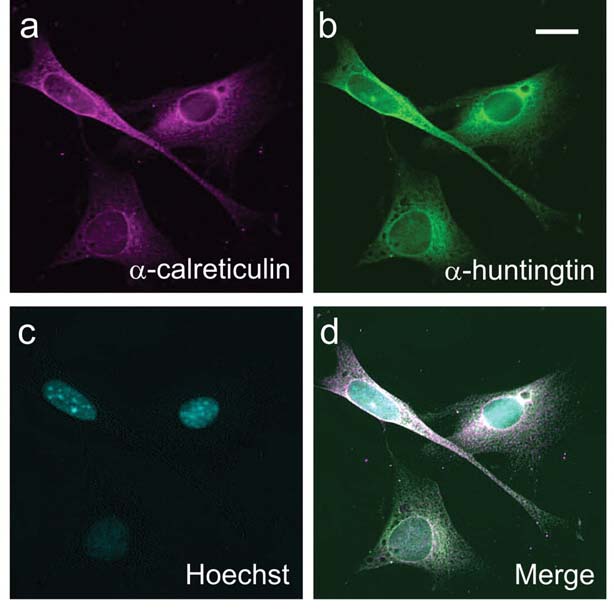
Después de probar fármacos que bloquean ochenta quinasas diferentes, el equipo descubrió que una quinasa en particular llamada ‘caseína quinasa 2’ – o ‘CK2’ – era particularmente importante. Como se esperaba, los fármacos que bloqueaban la CK2 hacían que la huntingtina estuviera mucho menos etiquetada en los sitios cruciales. Tenían el efecto de mantener la huntingtina fuera del núcleo, dirigiéndola en cambio a la parte de la célula de la ‘fábrica de proteínas’, el retículo endoplásmico o ‘RE’. En el proceso, el daño hecho a las células por la proteína se incrementó.
Espera, ¿¡hicieron la proteína MÁS tóxica!?
Por supuesto, un fármaco que hace que la huntingtina sea más tóxica es exactamente lo contrario de lo que nos gustaría lograr en las personas. Así que, no te apresures a ir a la farmacia y pedir una botella de inhibidor de CK2.
Si este trabajo va a conducir a tratamientos para los pacientes de la enfermedad de Huntington, querremos más huntingtina etiquetada, no menos. En esta etapa temprana, sin embargo, el equipo de Truant simplemente estaba tratando de averiguar qué quinasa era el objetivo más poderoso.
Al empeorar las cosas en las células con fármacos que bloquean la CK2, fueron capaces de confirmar que la CK2 es importante en el proceso de etiquetado que nos interesa. El trabajo futuro puede ahora dirigirse a la comprensión de cómo lograr el efecto inverso y hacer que la huntingtina sea menos tóxica.
Este trabajo, llevado a cabo en células en una placa, está muy lejos de generar tratamientos que puedan ser utilizados en pacientes. Pero es un importante paso adelante, que nos ayuda a entender uno de los actores clave en el daño a las células en la enfermedad de Huntington, y abre una nueva puerta para que los investigadores trabajen en futuros tratamientos.
Este artículo fue actualizado el 27 de junio para aclarar el efecto del etiquetado y los fármacos que bloquean la CK2.


