
Una actualización confirma que el ensayo de ‘silenciamiento génico’ de la enfermedad de Huntington va por buen camino
Ionis afirma que su ensayo de HTTRx, destinado a reducir la proteína huntingtina, está totalmente reclutado y planea ampliarlo

Ionis Pharmaceuticals lanzó el primer ensayo de un fármaco para reducir la huntingtina, a veces llamado ‘fármaco de silenciamiento génico’, a finales de 2015. En una actualización importante, la empresa ha anunciado dos hitos importantes: el ensayo está ahora totalmente reclutado y se activará una ‘extensión de etiqueta abierta’ para los voluntarios del ensayo actual. Aunque nada está garantizado, esto es un buen augurio para el futuro de este importante programa.
Un breve resumen sobre la reducción de la huntingtina
La idea de ‘desactivar’ la causa de la enfermedad de Huntington fue uno de los primeros pensamientos que surgieron en la cabeza de los investigadores cuando se descubrió el gen de la EH en 1993.
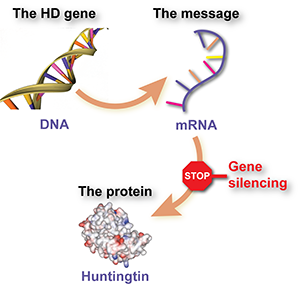
El primer gran avance para lograrlo se produjo hace una década, cuando varios estudios en ratones informaron del éxito en la reducción de la actividad del gen. Hacer eso redujo los niveles de la proteína para la que el gen es una receta:
Todos estos fármacos para reducir la huntingtina actúan de forma similar: ‘disparando al mensajero’. Un gen es una receta para una proteína, pero entre el gen y la proteína se crea un mensajero químico que es esencialmente una copia de trabajo del gen. Eliminar el mensajero rompe la cadena de producción, por lo que se produce menos cantidad de la proteína.
Los fármacos para reducir la huntingtina están hechos de moléculas similares al ADN, la sustancia que compone nuestros genes. Este tipo de sustancia química tiene la capacidad especial de adherirse fuertemente entre sí, si la secuencia de ‘letras’ genéticas coincide correctamente. Los fabricantes de fármacos pueden construir moléculas de diseño con una secuencia que se adhiera a la molécula mensajera del gen de la huntingtina, pero no a otros mensajeros.
Cuando la célula ve que el mensajero tiene una molécula de fármaco adherida, reconoce que ha ocurrido algo inusual y responde eliminando la molécula mensajera. Con el tiempo, esto reduce el nivel de la proteína.
Las propias moléculas del fármaco se presentan en muchos sabores diferentes. Algunas están hechas de ARN (la sustancia de la que está hecho el mensajero), mientras que otras están hechas de ADN (la sustancia de la que están hechos nuestros genes).
Una breve aclaración sobre la terminología. Mucha gente, incluido HDBuzz, se ha referido a ellos como fármacos de ‘silenciamiento génico’. Eso sugiere ligeramente que estamos intentando desactivar el gen por completo, lo cual probablemente no sea posible ni deseable. Por lo tanto, cada vez más, nos oirás llamarlos fármacos ‘para reducir la huntingtina’. Seguiremos utilizando la frase ‘silenciamiento génico’ de vez en cuando, para que la gente pueda encontrar el último artículo si busca en Google el término más conocido.
El ensayo actual
Cuando empezaron a trabajar en la EH hace más de una década, la empresa con sede en California que está detrás del ensayo actual se llamaba Isis Pharmaceuticals. Mucho ha cambiado desde entonces, incluido el nombre de la empresa: desde 2015 se llama Ionis.
El fármaco de Ionis es un oligonucleótido antisentido, u ASO. Esto significa que es una sola cadena de ADN modificado químicamente, diseñada para adherirse a la molécula mensajera del gen de la huntingtina.
Solo para que las cosas sean más emocionantes, el propio fármaco tiene dos nombres. Inicialmente se llamaba ISIS-443139, pero últimamente se le conoce como IONIS-HTTRx o simplemente HTTRx, una combinación de HTT, la abreviatura que utilizan los científicos para el gen de la huntingtina, y Rx, un símbolo utilizado en la industria farmacéutica que significa tratamiento o prescripción.
“El estudio de extensión de etiqueta abierta solo estará disponible para los voluntarios del ensayo actual”
(Dato curioso: el origen de ‘Rx’ es desconocido, pero puede provenir de la palabra latina ‘recipe’).
El ensayo de Ionis, dirigido en colaboración con la profesora Sarah Tabrizi del University College London, fue la primera vez que se probó en humanos un fármaco dirigido a reducir la huntingtina. Al igual que con el primer ensayo de cualquier fármaco nuevo, el objetivo principal del ensayo es la seguridad.
Para llegar al cerebro, los fármacos ASO como el HTTRx deben inyectarse en el líquido cefalorraquídeo mediante una aguja fina. Esto se denomina inyección intratecal. Aunque esto pueda sonar espantoso, es un método de uso común para tratar el cerebro en otras afecciones como el cáncer. Un procedimiento estrechamente relacionado, la punción lumbar o punción espinal, es muy utilizado, y de hecho, cientos de voluntarios de familias con la enfermedad de Huntington se han sometido a este procedimiento para donar valioso líquido cefalorraquídeo para ayudar a la investigación de la EH.
El actual ensayo de seguridad de HTTRx incluye a pacientes con síntomas tempranos de la enfermedad de Huntington. Tras una exhaustiva evaluación clínica, cada voluntario recibe cuatro inyecciones del fármaco a intervalos mensuales, seguidas de una recogida final de líquido cefalorraquídeo.
A lo largo del ensayo, se ha utilizado un brazo de placebo para ayudar a distinguir los efectos del fármaco de los efectos de participar en el ensayo, como el procedimiento de inyección. El ensayo tiene un diseño de escalada de dosis: al principio se administraron dosis muy bajas, y los voluntarios posteriores recibieron dosis más altas.
¿Qué hay de nuevo?
La nota de prensa de hoy de Ionis, la primera actualización oficial desde que comenzó el ensayo, trae noticias cautelosamente optimistas. Contiene dos anuncios importantes. En primer lugar, se ha completado el reclutamiento en el ensayo actual. Y en segundo lugar, la empresa está lanzando una extensión de etiqueta abierta al ensayo actual.
La finalización del reclutamiento es un hito importante para cualquier ensayo, pero para este es particularmente significativo. El ensayo involucró una serie de ‘primicias’: el primer fármaco ASO administrado a pacientes con EH, la primera vez que se utilizó la inyección intratecal en la EH, y cada escalada de dosis trajo tanto la esperanza de mayores beneficios como un mayor riesgo de efectos no deseados.
A lo largo de un ensayo como este, un comité independiente de expertos revisa periódicamente todos los datos de seguridad para buscar cualquier signo de peligro o daño. La noticia de que el ensayo está totalmente reclutado y de que los pacientes finales están pasando por los procedimientos es una fuerte sugerencia de que, incluso con las dosis más altas, la seguridad del fármaco parece buena. A pesar de las exhaustivas pruebas de seguridad antes de entrar en los pacientes, cualquier fármaco puede producir efectos no deseados, por lo que esa es realmente la mejor noticia que podríamos esperar escuchar en esta etapa.
En palabras de la nota de prensa: «El perfil de seguridad y tolerabilidad de IONIS-HTTRx en las cohortes completadas del estudio de fase 1/2a apoya su desarrollo continuado». Pulgares arriba para eso de nuestra parte.

Con el reclutamiento completo, Ionis está ahora en condiciones de establecer un calendario para la finalización del ensayo y la primera publicación de sus resultados. Se esperan los «resultados de primera línea» alrededor de finales de 2017. En nuestra experiencia, los resultados de un ensayo como este pueden no salir todos a la vez. Los datos de seguridad pueden ser los primeros, pero la información sobre si el tratamiento con HTTRx redujo el nivel de proteína huntingtina en el líquido cefalorraquídeo, un resultado ‘biomarcador’ muy esperado, puede tardar un poco más en materializarse.
Una extensión de etiqueta abierta
El ensayo actual de HTTRx tiene un diseño ciego: algunos voluntarios recibieron cuatro inyecciones que no contenían ningún fármaco activo, y ni los pacientes ni el personal del ensayo sabían quién recibía el fármaco o el placebo.
En un ensayo de extensión de etiqueta abierta, o OLE, se invita a los voluntarios de un ensayo ciego a volver para recibir más dosis, y cada voluntario recibe el fármaco activo en lugar de que algunos reciban el fármaco y otros el placebo, normalmente a la dosis más alta que se probó con seguridad en el ensayo ciego.
Ionis había dicho previamente que podría implementarse una extensión de etiqueta abierta si los datos del ensayo de seguridad parecían buenos. No queremos interpretar demasiado un breve anuncio, pero ejecutar una OLE no es barato para un patrocinador del ensayo, por lo que este anuncio ciertamente nos da optimismo sobre todo el programa HTTRx.
El estudio de extensión de etiqueta abierta solo estará disponible para los voluntarios del ensayo actual. Eso significa que se ejecutará en los mismos centros de estudio en el Reino Unido, Canadá y Alemania. La duración y el diseño exacto de la OLE aún no se han anunciado, pero proporcionará una gran cantidad de información que Ionis y su socio, Roche, pueden utilizar para planificar sus próximos pasos.
Agradeciendo a nuestros héroes
Una ventaja importante de una extensión de etiqueta abierta es que recompensa a los voluntarios que participaron en el estudio original dándoles acceso garantizado al fármaco activo. Estamos particularmente contentos con este aspecto del anuncio. Los participantes en este ensayo fueron todos miembros de familias con la enfermedad de Huntington que renunciaron a una cantidad significativa de tiempo para recibir inyecciones espinales de un fármaco que, al inicio del ensayo, nunca antes se había administrado a humanos. A los que se inscribieron más tarde se les administraron dosis más altas de las que nadie había recibido antes.
Cualquiera que sea el resultado, estos voluntarios aceptaron el riesgo personal, y en la mayoría de los casos lo hicieron para ayudar a otros más que a sí mismos. Toda nuestra comunidad tiene una deuda de gratitud con estos héroes por su valentía y servicio. Únase a nosotros para saludarlos en las redes sociales utilizando el hashtag #HDResearchHeroes.
¿Qué es lo siguiente?
“Ionis dijo: «el siguiente paso para este programa será llevar a cabo un estudio para investigar si la disminución de la proteína huntingtina mutante con IONIS-HTTRx puede ralentizar la progresión de esta terrible enfermedad»”
La extensión de etiqueta abierta comenzará pronto, probablemente en los próximos meses. Los sitios de estudio se pondrán en contacto con los voluntarios del ensayo de seguridad, con información sobre cómo y cuándo pueden inscribirse en la OLE. Mientras tanto, los participantes que aún se encuentran en el ensayo ciego deberán finalizar su participación antes de pasar a la extensión de etiqueta abierta.
Si no participó en el ensayo de seguridad ciego, no podrá inscribirse en la extensión de etiqueta abierta. No se ponga en contacto con los centros de estudio a menos que haya participado en el ensayo original.
Hacia finales de 2017, podemos esperar escuchar un anuncio oficial sobre los resultados del ensayo ciego. No se decepcione si eso se limita a los datos de seguridad en primera instancia. «Seguro y bien tolerado» debería ser música para los oídos de los familiares de EH después de un ensayo de este tipo.
Más adelante, tal vez a principios de 2018, puede haber un anuncio separado sobre algunos de los resultados más experimentales del ensayo de seguridad, como si HTTRx redujo el nivel de huntingtina en el líquido cefalorraquídeo.
La próxima gran noticia, si todo sigue yendo bien, puede ser un anuncio de un ensayo de eficacia, probando HTTRx durante el tiempo suficiente para determinar si ralentiza la progresión de la enfermedad. Roche ahora tiene el derecho de optar por participar, hacerse cargo del desarrollo del fármaco y ejecutar dicho ensayo basándose en su propio proceso de toma de decisiones. Con un poco de suerte, es posible que también tengamos noticias al respecto en los próximos meses.
Haciendo hincapié en su deseo de hacer avanzar el fármaco, en un anuncio separado hecho directamente a la comunidad de EH, Ionis dijo «Una vez finalizado el estudio, el siguiente paso para este programa será llevar a cabo un estudio para investigar si la disminución de la proteína huntingtina mutante con IONIS-HTTRx puede ralentizar la progresión de esta terrible enfermedad.»
Por el momento, no tenemos ni idea de cuándo comenzará el próximo gran estudio, pero nuestra mejor suposición sería a finales de 2018 o principios de 2019. En cuanto a cuándo, y cuántos pacientes, y qué países y sitios, es demasiado pronto para estar seguros, pero Ionis dice «Los futuros estudios para el programa se llevarán a cabo a nivel mundial
Nada sucede lo suficientemente rápido para las personas cuyas familias se ven afectadas por la EH, pero este es un momento para hacer una pausa y alegrarse de que, para este importante programa de reducción de la huntingtina, las noticias hasta ahora sean todas buenas.


