
Análisis de todo el genoma en busca de nuevas dianas farmacológicas para la EH
Los científicos analizan TODO el genoma para encontrar nuevas dianas terapéuticas potenciales para la EH. Este ambicioso estudio proporciona una gran cantidad de datos para los investigadores de la EH

Un estudio publicado recientemente en la revista ‘Neuron’ ha identificado nuevas dianas terapéuticas potenciales para el tratamiento de la enfermedad de Huntington (EH). El trabajo realizado por la profesora Myriam Heiman y sus colegas utilizó tecnologías genéticas de vanguardia y descubrió que varios genes podrían modificar la progresión de la EH en sus modelos en el laboratorio. Muchos de estos genes no se habían relacionado antes con la EH y podrían ser nuevas dianas interesantes para que los investigadores las exploren al desarrollar fármacos y tratamientos para la comunidad de pacientes con EH.
Análisis ambicioso de todo el genoma
Las células de nuestro cuerpo contienen ADN que codifica miles de genes, cada uno de los cuales es una receta que da instrucciones a nuestras células sobre cómo fabricar una molécula de proteína diferente. Estas recetas se transcriben de nuestro ADN a un mensaje llamado ARN mensajero. A continuación, la maquinaria celular traduce el ARN en moléculas de proteína. Los científicos pueden manipular estos procesos en el laboratorio para comprender la función de los diferentes genes en nuestro cuerpo.
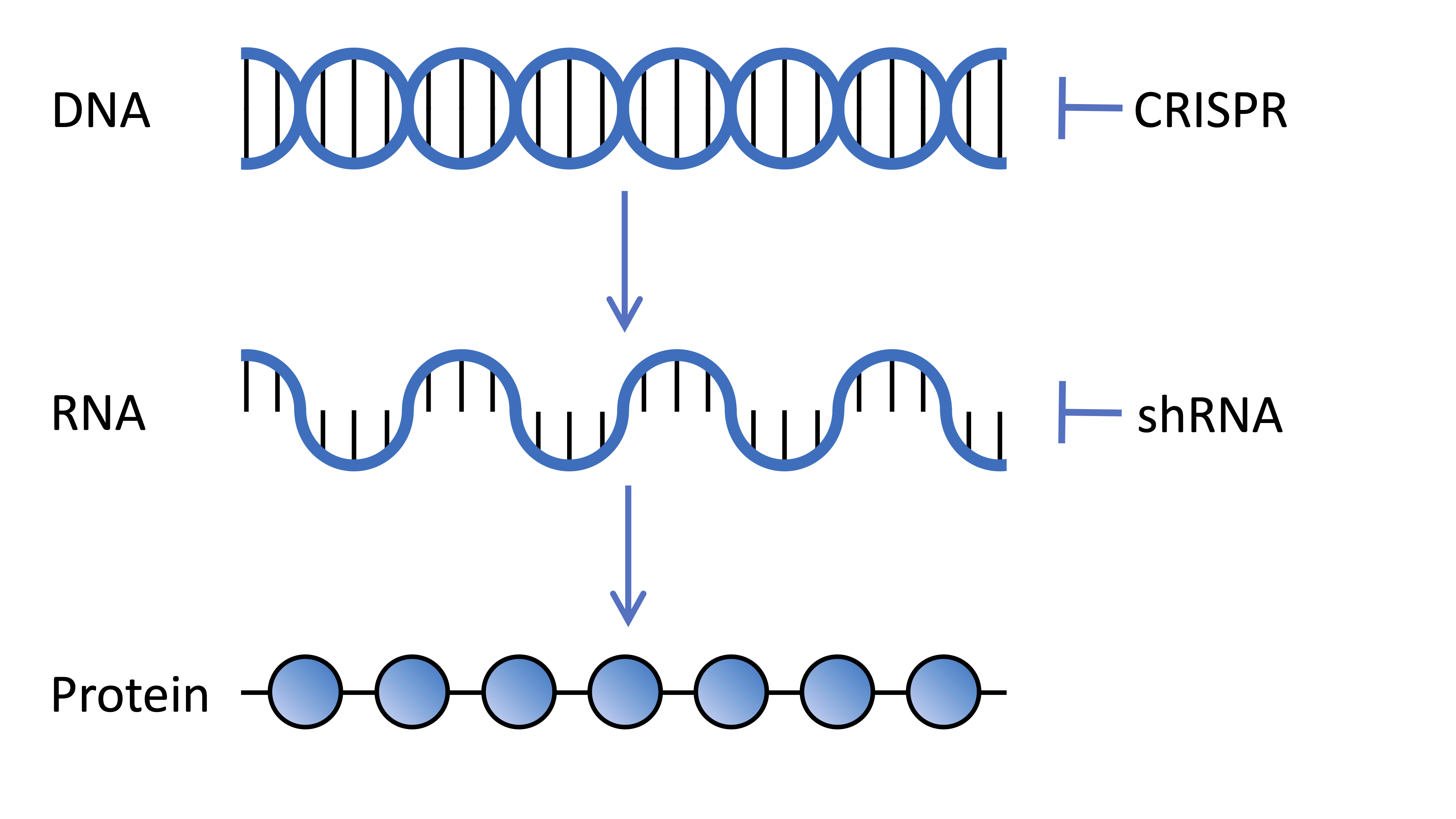
Los cribados genéticos buscan comprender la función de un solo gen en diferentes contextos; en este caso, los investigadores estaban interesados en la función de todos los diferentes genes de nuestras células para proteger contra los efectos dañinos de la mutación de la EH. Así que la idea es meterse con cada gen a su vez, para tratar de descubrir si ese gen tiene algún impacto en los síntomas de la EH.
Las tecnologías de cribado genético pueden funcionar de muchas maneras diferentes, pero todas tienen como objetivo detener o reducir la expresión de proteínas de genes específicos. Los genes pueden ser atacados directamente editando el propio genoma. Otras tecnologías interfieren con el ARN mensajero que se transcribe del gen y es esencial para que las células fabriquen la proteína que codifica el gen.
Esto podría sonar familiar a los lectores de HDBuzz, ya que se trata de tecnologías similares a las que se utilizan en las terapias de reducción de la huntingtina que se están evaluando actualmente en varios ensayos clínicos. Mientras que estas terapias de reducción de la huntingtina se dirigen solo al gen de la huntingtina, en el caso de este cribado genético, los investigadores se dirigen a todos los genes del genoma, uno por uno, para determinar el papel que desempeñan en la EH.
El Broad Institute, donde tiene su sede el Prof. Heiman, es un líder mundial en el desarrollo de bibliotecas que pueden utilizarse para los cribados genéticos. En este estudio, los investigadores utilizaron dos tecnologías diferentes en su cribado, ambas administradas a las células cerebrales por tipos especiales de virus. En primer lugar, los ARN de horquilla corta que se dirigen al ARN mensajero y reducen la expresión del gen interrumpiendo el mensaje para que no se traduzca en la molécula de proteína funcional. En segundo lugar, se utilizó CRISPR para editar directamente la secuencia del gen en el genoma, interrumpiendo su capacidad de activarse para fabricar la proteína que codifica.
Los cribados genéticos sistemáticos en diferentes modelos animales existen desde hace décadas para sistemas más simples como los gusanos y las moscas. Sin embargo, este tipo de experimentos han sido mucho más difíciles de realizar técnicamente para los cerebros de los mamíferos, lo que ha supuesto un obstáculo para los científicos interesados en realizar estos cribados para comprender diferentes enfermedades neurodegenerativas.
El equipo del Prof. Heiman pudo superar estas dificultades encontrando una forma de agrupar y concentrar los reactivos que deben inyectarse en los cerebros de los ratones en el cribado genético, y pudo dirigirse directamente al cuerpo estriado, que es el área del cerebro que les interesaba estudiar. El cuerpo estriado es la región del cerebro más afectada en los pacientes con EH, por lo que se eligió esta área.
Se investigaron más de 20.000 genes en este estudio
En lugar de observar genes familiares asociados con la neurodegeneración en sus modelos de ratón, los científicos de este estudio adoptaron un enfoque imparcial y completaron un cribado de todo el genoma para observar el papel desempeñado por casi todos los genes. De hecho, ¡analizaron casi todos los aproximadamente 22.000 genes que se encuentran en los ratones! Este fue un enfoque increíblemente ambicioso y proporciona una gran cantidad de datos a los investigadores en el campo de la EH y más allá.
Como este fue el primer cribado sistemático de todos los genes en el sistema nervioso central de mamíferos, los investigadores utilizaron ratones normales sin mutaciones conocidas para determinar qué genes son importantes en la supervivencia de las células cerebrales en condiciones normales. Se demostró que los genes que se habían identificado previamente en cribados sistemáticos en modelos más simples, como moscas y gusanos, también eran importantes en ratones.
Sin embargo, en este estudio se identificaron muchos genes nuevos, incluidos varios que desempeñan un papel en el metabolismo de las células. Estos no se identificaron previamente en otros cribados sistemáticos en moscas o gusanos, lo que probablemente se deba a que el sistema nervioso central de los mamíferos requiere más energía y depende más de los genes que ayudan a las células a producir energía. Estos hallazgos son un buen recordatorio de lo importante que es para los científicos considerar los hallazgos de su investigación en el contexto de los modelos animales que se investigan.

Además del modelo de ratón de control, se utilizaron dos modelos de ratón de EH diferentes en este experimento, R6/2 y zQ175, ambos descritos ampliamente en la literatura de investigación de la EH. Al comparar los genes identificados en el cribado en los modelos de ratón de EH con los identificados en los ratones de control, los científicos pudieron determinar qué genes eran específicamente importantes para la EH, en lugar de los genes que afectan la función de las células cerebrales de manera más general.
Para los cribados genéticos realizados en los dos modelos de ratón de EH utilizados en el estudio, se identificaron aproximadamente 500 genes como importantes en la progresión de la EH. Muchos de estos genes desempeñan un papel en las vías que los científicos han identificado previamente en otros estudios, como los estudios de asociación de todo el genoma (GWAS) que buscaron genes que pueden alterar la edad de inicio de los síntomas de la EH en pacientes humanos. Estos incluyen genes involucrados con las vías de reparación del daño del ADN que mantienen la integridad de nuestro material genético, así como genes en las vías de transcripción que regulan cómo se procesa el ARN mensajero en las células y, por lo tanto, qué moléculas de proteína se fabrican.
También se identificaron nuevas dianas genéticas en el cribado, incluidos los genes pertenecientes a la familia Nme. Se ha informado previamente que los genes Nme están relacionados con la propagación en algunos cánceres, pero esta es la primera vez que se han conectado con la EH. Heiman y sus colegas creen que atacar la vía Nme puede ser importante para ayudar a las células cerebrales a deshacerse de la proteína huntingtina mutante en los cerebros con EH. Si podemos diseñar terapias que modulen esta vía, esta podría ser una forma potencial de ayudar a tratar la EH.
Nuevas pistas para fabricar nuevos medicamentos para la EH
Incluso con muchos ensayos clínicos innovadores en curso que prueban diferentes terapias para pacientes con EH, es importante que los investigadores continúen buscando formas alternativas de fabricar potencialmente nuevos medicamentos para la EH. Esta investigación proporciona una gran cantidad de datos sobre la EH, ya que funciona en cerebros de modelos de ratón, y también nos da ideas de nuevas dianas para buscar como posibles dianas farmacológicas, que algún día pueden terminar en la línea de descubrimiento de fármacos. Será emocionante ver cómo los investigadores de todo el mundo dan seguimiento a estas nuevas pistas y también cómo esta tecnología podría aplicarse a otras enfermedades neurodegenerativas.


