Conferencia sobre terapeútica de la enfermedad de Huntington 2024 - Día 1
Consulte las actualizaciones de investigación del día 1 de la Conferencia sobre Terapéutica de la EH de 2024 #HDTC2024
Editado por Dr Rachel Harding, Dr Sarah Hernandez, y Dr Leora Fox 07 de marzo de 2024 Por Dr Leora Fox, Dr Rachel Harding, y Dr Sarah Hernandez Traducido por Asunción Martínez Publicado originalmente el 05 de marzo de 2024
El equipo de HDBuzz se reunió recientemente en Palm Springs, California, junto con cientos de otros científicos de todo el mundo, para la 19ª Conferencia Anual sobre Terapéutica de la EH, organizada por la fundación de investigación de la EH CHDI. Desde el martes 27 de febrero hasta el jueves 29 de febrero, tuiteamos en vivo docenas de charlas científicas impartidas por expertos mundiales en la investigación de la enfermedad de Huntington, desde científicos hasta médicos. Hemos recopilado nuestros tweets en un resumen de toda la conferencia, comenzando con el día 1.
Trabajo de la huntingtina: Enseñar nuevos trucos a un viejo dogma
La primera sesión de la conferencia se centró en la huntingtina, el gen que se expande para causar la EH. La reunión comenzó con Gill Bates, quien revisó lo que sabemos sobre la genética de la EH, que es que la longitud de las repeticiones CAG en el gen de la huntingtina dicta si las personas desarrollarán EH. Más recientemente, se ha implicado que el alargamiento de la repetición CAG en algunas células cerebrales, conocido como expansión somática, es un factor que impulsa la enfermedad.

Hay muchas preguntas sin respuesta sobre cómo exactamente la expansión CAG produce la muerte de las células cerebrales. Esta sesión abordó una amplia gama de enfoques, a nivel epigenético, de ARN y de proteínas.
Karine Merienne: etiquetas de ADN en el cuerpo estriado
La primera ponente de la conferencia fue Karine Merienne de la Universidad de Estrasburgo que nos habló de los cambios en cierto tipo de marcadores en la EH asociados al envejecimiento. Karine nos recordó que todavía es un misterio por qué las células nerviosas del cuerpo estriado son tan vulnerables a la expansión CAG en el gen de la huntingtina. Una hipótesis que está investigando son los cambios en cómo se activan y desactivan los genes.
La investigación de Karine analiza cómo se producen los llamados cambios epigenéticos en la EH. Estos no son cambios en el código del ADN en sí, sino ciertos marcadores que afectan la forma en que se empaqueta el ADN. Esto, a su vez, cambia qué genes se activan o desactivan, lo que afecta las propiedades de las células, convirtiendo a una célula nerviosa en una célula nerviosa o a una célula de la piel en una célula de la piel.
Los marcadores epigenéticos cambian con la edad en todas las personas, no sólo en las personas con EH. El equipo de Karine descubrió que ciertos marcadores epigenéticos se alteran aún más en modelos de EH en ratones. Utilizando tecnologías de vanguardia, pudieron observar cambios en los marcadores a nivel de células cerebrales individuales de un ratón. Vieron que, a las células nerviosas del cuerpo estriado, la región cerebral vulnerable en la EH, les faltaba una marca epigenética importante.
Esto nos da una idea de por qué las células del cuerpo estriado podrían tener más probabilidades de enfermarse en personas con EH. Quizás si podemos corregir estas marcas epigenéticas, ¿podríamos mejorar las células? ¡Veremos!; ¡Hay mucha gente inteligente trabajando en esto!
Yinsheng Wang: etiquetas químicas que causan estragos
La siguiente charla de la mañana provino de Yinsheng Wang, que trabaja en la Universidad de California, Riverside. Yinsheng investiga cómo se modifican las moléculas de mensajes genéticos con etiquetas químicas en la EH y otras enfermedades CAG.
Los CAG repetidos en el mensaje del gen de la huntingtina pueden “etiquetarse” con moléculas adicionales. En el curso de la EH, las etiquetas adicionales pueden reclutar proteínas en la célula de manera inapropiada, absorbiéndolas e impidiéndolas realizar sus funciones normales. Curiosamente, estos cambios en las etiquetas de la molécula mensajera de la huntingtina parecen ocurrir con mayor frecuencia en el cuerpo estriado de ratones con EH. ¿Podría ser esta otra razón por la que estas células cerebrales se dañan más?
Máquinas moleculares especiales añaden o eliminan estas etiquetas de la molécula mensajera de la huntingtina. Yinsheng y sus colegas descubrieron cuál de estas máquinas era responsable de los cambios que podían medir. Si se deshacían de la máquina, las etiquetas de las moléculas del mensaje volvían a la normalidad.
También descubrieron que los cambios en las etiquetas moleculares alteran la capacidad del mensaje de la huntingtina para adherirse a una proteína llamada TDP-43, que desempeña un papel en otras enfermedades neurodegenerativas. (Como la huntingtina, el TDP-43 también puede formar grupos). La huntingtina y sus repeticiones y etiquetas CAG pueden afectar la formación de estos grupos. Los datos de este equipo sugieren que las repeticiones expandidas en la molécula mensajera de la huntingtina condujeron a la agrupación de TDP-43.
Yinsheng explica otra forma en que las etiquetas químicas de la molécula mensajera de la huntingtina pueden causar estragos en la célula: al hacer que la molécula mensajera se desequilibre y produzca proteínas tóxicas que no debe codificar. Tal vez si podemos restaurar la forma en que estas máquinas moleculares etiquetan la molécula del mensaje de la EH, las células cerebrales se enfermarán menos. Esta es una nueva e interesante vía para la investigación del descubrimiento de fármacos en el campo de la EH.
*Jeff Carroll: ¿cuánto deberíamos bajar? *
También escuchamos al propio Jeff Carroll de HDBuzz. El laboratorio de Jeff, con sede en la Universidad de Washington, ha estado ocupado investigando la reducción del HTT en modelos de EH en ratones. El laboratorio de Jeff pregunta qué pueden hacer para ayudar a acelerar y mejorar las estrategias clínicas para reducir la huntingtina. Una pregunta importante es cuánto reducir la huntingtina y en qué tipos de células mejorar los síntomas de la EH sin efectos negativos.
Las preguntas clave que el equipo de Jeff está tratando de responder es cuánto tenemos que reducir la huntingtina sin que sea peligro y cuánto tenemos que reducir para obtener un efecto positivo. Los experimentos en ratones han demostrado que bajar demasiado podría no ser muy bueno. Uno de los proyectos en los que ha estado trabajando el laboratorio de Jeff es analizar la reducción de la huntingtina en ratones adultos. Esto representa lo que estamos haciendo en la clínica: administrar a personas adultas con EH diferentes tipos de medicamentos para reducir los niveles de la proteína huntingtina.
El laboratorio de Jeff demostró que no era seguro eliminar completamente la huntingtina del cerebro de los ratones: ¡literalmente tenían agujeros en el cerebro! Por supuesto, la eliminación completa de la huntingtina en el cerebro humano no es el objetivo de los ensayos clínicos. Probablemente el truco consistirá en conseguir el equilibrio adecuado. Jeff reitera que esto no significa que reducir la huntingtina sea una mala idea per se, sólo tenemos que determinar hasta dónde llegar.
Sabemos por estudios genéticos que el 50% de reducción (lo que apuntan la mayoría de los ensayos clínicos) sería lo adecuado en personas y modelos animales de EH, pero quizás por debajo de esa cifra no sea una buena idea. Una cosa interesante que el grupo de Jeff notó fue que la reducción de huntingtina con ASO en ratones parece alterar la inestabilidad somática, la expansión de la repetición CAG en algunas células. Esto parece ocurrir en el hígado con dosis muy altas de ASO. ¡Descubrir por qué es así ha sido complicado!
Más importante aún, ¿harían lo mismo los enfoques clínicos, que utilizan menores cantidades de ASO? No lo parece. Pero probablemente sea algo a lo que los científicos deberían estar atentos en el futuro.
A continuación, el equipo de Jeff analizó enfoques de reducción selectiva: terapias que solo se dirigen a la huntingtina tóxica y dejan intactos los niveles normales de huntingtina. Nuevamente vieron que la inestabilidad somática parecía ser bloqueada por estos tratamientos: ¡podrían ser dos terapias interesantes por el precio de una!
«Los descubrimientos en el ámbito de la inestabilidad somática habrían sido imposibles sin la dedicación de las familias con EH y su voluntad de participar en la investigación. »
En conjunto, el trabajo de Jeff nos está ayudando a comprender mejor lo que significa la reducción de la huntingtina a nivel molecular, lo que nos ayudará a comprender mejor lo que está sucediendo en los ensayos clínicos actuales y cualquier consideración adicional en la que debamos pensar para darle a este enfoque su mejor oportunidad.
Ileana Cristea: la huntingtina y sus parejas de baile
Volvemos y la siguiente es Ileana Cristea, quien dirige un grupo de investigación en la Universidad de Princeton. Estudian la proteína huntingtina y otras proteínas con las que le gusta estar en las células, y cómo estas relaciones cambian en la EH. Este trabajo se ubica en el área de la investigación “omics”, donde los investigadores observan los cambios en las proteínas y cómo interactúan en muchas células, tejidos y áreas del cerebro. ¡Hay un tremendo esfuerzo de colaboración!
La charla de Ileana continúa con el tema de descubrir por qué algunas células se dañan en la EH, mientras que otras parecen estar bien. Su laboratorio analiza la ubicación de diferentes proteínas y cuáles se juntan. Están tratando de abordar qué impulsa las enfermedades y cuáles son las consecuencias de reducir los niveles de huntingtina con medicamentos. Lo hacen estudiando qué proteínas interactúan en presencia y ausencia de huntingtina.
Descubrieron que en células de ratones que no tenían la proteína huntingtina, los niveles de todo tipo de proteínas cambiaban, así como también qué proteínas estaban juntas. Los mayores cambios se produjeron en las proteínas que desempeñan funciones en la generación de energía y la reparación del ADN. El siguiente paso fue comprender cómo estos cambios conducen a la enfermedad, por lo que se concentraron en el cuerpo estriado de los ratones con EH, ya que esta es la región del cerebro más afectada en la EH.
Redujeron una lista de proteínas involucradas en funciones celulares específicas que pueden darnos pistas sobre lo que sale mal en la EH. Después de obtener una visión general de las redes que interactúan, confirmaron algunos de sus “éxitos” en colaboración con científicos que trabajan en otros modelos y técnicas, como células y moscas de la fruta. En diferentes tipos de células, diferentes proteínas compañeras de la huntingtina están alteradas, lo que una vez más podría explicar por qué diferentes células se ven afectadas de diferentes maneras en la EH.
El equipo de Ileana no solo puede determinar con qué proteínas se une la huntingtina, sino también a través de qué superficies podrían unirse, brindando una visión molecular muy detallada de lo que sucede en la EH. Aunque este tipo de estudio puede parecer un poco granular, en realidad es muy importante para ayudarnos a comprender exactamente qué es lo que falla en la EH. También nos ayuda a identificar nuevos genes y proteínas que podrían ser buenos objetivos para futuros esfuerzos de descubrimiento de fármacos.
Tony Reiner: patrones de grupos de huntingtina
La última charla de la mañana provino de Tony Reiner, que trabaja en el Centro de Ciencias de la Salud de la Universidad de Tennessee. Su equipo ha estado investigando dónde se encuentra la forma patológica de la proteína huntingtina en los cerebros humanos y de ratones con EH.
Tony primero nos recordó las partes específicas del cerebro que son más vulnerables en la EH. El cuerpo estriado, que se encuentra en el centro del cerebro, es una de las regiones cerebrales más afectadas, pero las células nerviosas de la corteza y el tálamo también se ven afectadas. Las regiones del cerebro que producen una gran cantidad de proteína huntingtina no son necesariamente las más afectadas en la EH. La huntingtina normal se encuentra realmente en todas partes, por lo que esto no parece explicar por qué las células del cuerpo estriado son tan vulnerables.
La proteína huntingtina vienen en muchos sabores diferentes: expandidas, fragmentadas, agrupadas y otras. El grupo de Tony utiliza anticuerpos como herramientas para visualizar las diferentes formas de la proteína huntingtina en el cerebro. Comenzaron mirando cerebros de ratones con EH y trataron de compararlos con tejido de personas con EH que generosamente donaron sus cerebros para la investigación después de fallecer. Este acto desinteresado ha sido fundamental para generar datos que nos permitan saber qué sucede con la EH en el cerebro humano.
Si está interesado, puede obtener más información sobre las donaciones de cerebros en Brain Donor Project (https://braindonorproject.org/), organizaciones HDSA, HSC y asociaciones en su país de origen y a través de instituciones académicas locales.
Podemos medir muchos cambios en las células cerebrales a lo largo del tiempo, pero aún no está muy claro qué cambios realmente causan que las células se enfermen. El trabajo de Tony muestra que el aumento de los grupos de proteínas y otras mediciones no siempre parecen coincidir con las células que sabemos que enferman. El trabajo del laboratorio de Tony y de otros realmente analiza estas mediciones al nivel de diferentes tipos de células que algún día podrían ayudarnos a comprender mejor la causa y el efecto.
Dirigirse a la maquinaria de reparación del ADN para modular la inestabilidad somática
La segunda sesión de la conferencia se centró en formas de combatir la expansión de las repeticiones de CAG. Esto sucede en algunas células a medida que los síntomas de la EH empeoran. Mucha evidencia nueva señala que el alargamiento de las repeticiones CAG es un factor importante de la pérdida de células en el cuerpo estriado, lo que empuja la aparición más temprana de los síntomas. Utilizando sangre donada por miles de personas con EH, los científicos han podido realizar grandes estudios genéticos (conocidos como GWAS) para determinar otros genes que afectan la aparición de la EH. En particular, muchos de estos genes están involucrados en algo llamado reparación del ADN.
La reparación del ADN es un proceso en el que pequeñas máquinas moleculares reparan errores o cambios en el código ortográfico del ADN. Uno de esos cambios que ocurre en la EH es el aumento de la repetición CAG. Algunas personas tienen máquinas de reparación de ADN que son excelentes para detectar errores, mientras que otras tienen máquinas que no son tan buenas. Cuando falla la maquinaria de reparación del ADN, la repetición CAG puede alargarse en algunas células con el tiempo.
Muchos científicos de la EH ahora creen que, al apuntar a los genes de reparación del ADN, podría ser posible ralentizar el alargamiento de las repeticiones CAG en células cerebrales vulnerables, lo que en última instancia retrasaría la aparición o ralentizaría el empeoramiento de los síntomas de la EH. Cada vez más científicos y empresas buscan, confirman y prueban diferentes actores dentro de la maquinaria que repara el ADN, para determinar qué sale mal cuando las repeticiones CAG se hacen más largas y tratar de prevenirlo.
Estaremos lanzando muchos acrónimos y nombres de proteínas que se sabe que están involucradas en el proceso de reparación del ADN. Estas proteínas trabajan juntas para reparar el ADN de diferentes maneras y pueden fallar en la EH. Los científicos están desarrollando fármacos genéticos para aumentar o disminuir sus niveles y detener la expansión de CAG.
Maren Thomsen: la forma de las máquinas de reparación de ADN
La primera oradora de la tarde fue la bióloga estructural, Maren Thomsen, de una empresa llamada Proteros Biostructures. Ella está estudiando la forma de una proteína llamada MutSꞵ que participa en la reparación del ADN. Usando microscopios especiales, pueden ver exactamente cómo está organizada la proteína en el espacio 3D, lo que puede ayudar a los científicos a descubrir cómo funciona.
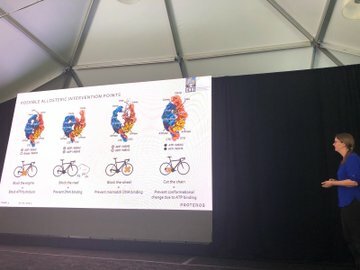
Idealmente nos gustaría detener la actividad de MutSꞵ, y hay diferentes maneras de hacerlo. Maren utiliza la analogía de intentar detener el movimiento de una bicicleta: podrías detener los pedales, poner una barricada delante de ella o bloquear la rueda para que no gire. Conocer los detalles de la estructura de MutSꞵ les permite idear diferentes formas de detener su actividad.
Unos microscopios geniales permiten a Maren y su equipo determinar con precisión dónde está cada átomo de la proteína y cómo cambia esto a medida que MutSꞵ realiza su trabajo deslizándose y reparando el ADN. Con esta alta resolución de información, pueden crear un modelo súper detallado de cómo funciona esta máquina molecular. ¡Realmente puede moverse, agarrarse y abrirse alrededor del ADN como una abrazadera! Cuando el equipo de Maren realiza cambios en la máquina MutSꞵ, ésta cambia su agarre y movimiento, y están aprendiendo más sobre qué partes de la proteína se adhieren a otros participantes en el proceso de reparación del ADN.
Maren también está investigando una proteína llamada FAN1, junto con sus “compañeros de baile”. FAN1 también participa en la reparación del ADN y su grupo ha podido visualizarlo de nuevas formas con el objetivo de aprovecharlo para el desarrollo de fármacos. Con estos conocimientos detallados sobre cómo funcionan todas estas moléculas juntas, podemos comenzar a comprender por qué ciertas mutaciones encontradas en GWAS podrían retrasar o acelerar la edad de aparición de los síntomas de la EH.
Las técnicas de biología estructural iluminan la forma y el movimiento de moléculas críticas para que podamos comprender mejor dónde y cómo intervenir en la biología defectuosa de la enfermedad de Huntington y diseñar fármacos que se dirijan con precisión a proteínas como MutSꞵ.
Wei Yang: MutSꞵ y repeticiones CAG largas
A continuación, escuchamos a otro biólogo estructural, Wei Yang, que trabaja en los Institutos Nacionales de Salud y también está estudiando MutSꞵ. La máquina molecular MutSꞵ actúa sobre todo tipo de secuencias repetidas de ADN, no solo sobre repeticiones CAG. El equipo de Wei trabajó para descubrir exactamente cómo se une MutSꞵ a estas letras repetidas de ADN utilizando enfoques de biología estructural.
Un enigma interesante es por qué existe un umbral de CAG en el que las repeticiones continúan expandiéndose con el tiempo. Comprender esto requiere experimentos interesantes que observen el ADN repetido de CAG y cómo se une a MutSꞵ. Wei y su equipo descubrieron que MutSꞵ prefiere vincularse a repeticiones CAG más largas que a las más cortas. De hecho, si la extensión de CAG es lo suficientemente larga, más de una molécula de MutSꞵ se unirá al ADN de CAG.
Cuando miran el ADN CAG pegado a MutSꞵ, ven que MutSꞵ contorsiona el ADN repetido CAG para que parezca ADN no repetido. Funciona como un tornillo de banco para doblar el ADN en esta forma diferente. Como era de esperar, esto requiere mucha energía. Pero, ¿qué significa todo esto para la EH? Bueno, cuando los CAG se repiten lo suficiente, como ocurre en las personas con EH, se unen cada vez más moléculas MutSꞵ. Wei cree que esto puede alentar involuntariamente la expansión del CAG.
Los estudios de biología estructural nos ayudan a confirmar los hallazgos de personas que han revelado la importancia de la reparación del ADN en la EH. Estamos aprendiendo más sobre los genes y la maquinaria implicados en la inestabilidad somática y cómo podría estar relacionada con la aparición de los síntomas. Armados con este tipo de conocimiento, los cazadores de drogas pueden trabajar para encontrar formas de evitar que MutSꞵ cometa errores que alarguen los CAG, con el objetivo de ralentizar o detener la EH.
De hecho, Wei y su equipo han identificado un compuesto que cambia la forma en que MutSꞵ se adhiere al ADN CAG. Aunque no es probable que esta molécula sea una droga, podría ser un punto de partida útil para los cazadores de drogas.
Sarah Tabrizi: explorando la reparación del ADN en células humanas
La siguiente fue la legendaria Sarah Tabrizi, médica y científica del University College London que participa en muchas investigaciones básicas y clínicas de la EH. Sarah está utilizando células humanas cultivadas en una placa para probar más a fondo muchos de los genes identificados como importantes para la reparación del ADN y la expansión de repeticiones CAG. Hay muchas proteínas reparadoras del ADN que parecen buenos objetivos para las terapias.
Sarah y su equipo están utilizando técnicas genéticas como CRISPR para reducir los niveles de proteínas reparadoras del ADN que fallan en la EH. Luego ven cómo esto afecta los niveles de otros genes, para descubrir las relaciones entre la maquinaria de reparación del ADN. Después de cambiar los niveles de diferentes proteínas reparadoras del ADN, el equipo de Sarah observó cómo esto afectaba la expansión de las repeticiones CAG. Se dirigieron a genes llamados MSH2 y MSH3. Reducir estos (y otros) redujo el nivel de expansión somática.
En las células madre inducidas a convertirse en células cerebrales, la reducción de un gen específico de reparación del ADN llamado MLH1 redujo la expansión somática en un 78%. ¡Guau! También está explorando otros objetivos, incluido un gen llamado MSH3, al que llama “un objetivo terapéutico ideal”. Su trabajo destaca dos proteínas reparadoras llamadas MLH1 y PMS1 como objetivos farmacológicos potencialmente interesantes. Trabajar en objetivos más allá del complejo MutSꞵ podría ser realmente útil para aumentar nuestras probabilidades de encontrar medicamentos que funcionen.
No obstante, Sarah reitera que MSH3 es su objetivo farmacológico favorito, ya que eliminarlo parece ralentizar la expansión repetida de CAG. Además, agotar esta proteína no parece tener demasiados efectos secundarios negativos, al menos en los modelos. El laboratorio de Sarah utiliza ASO para reducir los niveles de MSH3, el mismo tipo de fármaco que algunas empresas (como Roche) utilizan para reducir la huntingtina. Cuando redujeron los niveles de MSH3, esto ralentizó la expansión somática. Cuando eliminaron por completo MSH3, las repeticiones CAG se hicieron más pequeñas. Esto no afectó a otras proteínas reparadoras del ADN, lo cual es una noticia positiva para el descubrimiento del fármaco MSH3.
Casi todo este trabajo se realizó en células nerviosas en un plato, que había sido creado a partir de una muestra de sangre donada generosamente por un paciente joven que Sarah estaba tratando antes de su fallecimiento. Estos descubrimientos y muchos otros en el ámbito de la inestabilidad somática habrían sido imposibles sin la dedicación de las familias con EH y su voluntad de participar en la investigación. El equipo de Sarah continúa este trabajo en un modelo de ratón para ver cómo les va a sus ASO MSH3 en un sistema más complejo. ¡Mira este espacio!
Ricardo Mouro Pinto: explorando genes reparadores del ADN como objetivos potenciales
Ricardo Mouro Pinto trabaja en el Hospital General de Massachusetts y la Facultad de Medicina de Harvard. Su equipo también estudia la expansión somática. Los pacientes con mayor inestabilidad somática comienzan a tener síntomas de la EH antes. Los genes que influyen en la aparición de los síntomas se conocen como modificadores genéticos. Ricardo y otros están probando la teoría de que cambiar los niveles de estos modificadores puede retrasar o detener la aparición de la EH.
Ricardo está usando CRISPR para cambiar los niveles de estos modificadores en ratones que modelan la EH. Ha analizado 60 genes diferentes en ratones: ¡es mucho trabajo! Lo que todo ese trabajo encontró es que los genes de reparación del ADN tienen un gran efecto en la longitud de las repeticiones CAG. Esto confirma lo que muchos otros en el campo han encontrado. Cada vez que los resultados se replican en varios laboratorios de todo el mundo, se fortalece la confianza del campo en esos datos.
Luego pasó a células humanas cultivadas en un plato para confirmar sus propios datos y los de otros. Descubrieron que reducir MSH3 ralentiza la tasa de expansión y reducir FAN1 la aumenta. También descubrieron que la reducción de los niveles de MLH3 y PMS1 detiene las expansiones. Ricardo también está trabajando para comprobar estos objetivos modificadores en otras enfermedades. La EH no es la única enfermedad afectada por la expansión somática. Por eso está examinando los objetivos que identificó en la EH en ratones que modelan otras enfermedades, como la ataxia de Frederich.
Apuntar a la misma proteína que está implicada en múltiples enfermedades no sólo beneficia a más personas, sino que también podría acelerar la realización de ensayos y el desarrollo de fármacos. Pero antes de adelantarnos, estos objetivos deben probarse más para garantizar que tengan el efecto que queremos. Un punto que los investigadores deben tener en cuenta es que los genes de reparación del ADN también están implicados en el cáncer. Ricardo es consciente de esto y elige posibles objetivos farmacológicos con las menores posibilidades de provocar cáncer en las personas.
Un objetivo en el que el equipo de Ricardo está particularmente interesado se llama MLH3. Hicieron algunos estudios detallados para ver exactamente qué parte del gen MLH3 es responsable de la expansión somática en la EH. Saber exactamente qué parte del gen es responsable de influir en la longitud de CAG permite a los investigadores saber a qué punto tendrían que apuntar si diseñaran un fármaco contra MLH3.
Utilizando técnicas genéticas geniales, Ricardo puede producir células que producen una versión de MLH3 que excluye la parte del código que conduce a la expansión repetida de CAG. Cuando hizo esto, pudo suprimir las expansiones de CAG. Ahora está trabajando para utilizar CRISPR para cambiar una sola letra en la secuencia de MLH3. Este es un enfoque preciso que evitará que MLH3 aumente el número CAG y dejará en paz el resto de las funciones de MLH3.
Esto es importante porque las proteínas de las células tienen muchas funciones diferentes. Apuntar a una sola función reduce las posibilidades de tener consecuencias no deseadas. ¡Algo que es fundamental para el diseño de fármacos! Los próximos pasos de Ricardo son utilizar sus nuevos enfoques CRISPR para alterar MLH3 en ratones y células humanas en un plato. Por esto, Ricardo recibió recientemente una subvención de $1,000,000 de ¡la Fundación para Enfermedades Hereditarias!
Karen Usdin: expansión somática en otras enfermedades
Karen Usdin de los Institutos Nacionales de Salud habló sobre el trabajo de su equipo que analiza la expansión somática en diferentes tipos de enfermedades causadas por repeticiones del ADN, más allá de la EH. Hay muchas enfermedades causadas por secuencias repetitivas de ADN. El equipo de Karen se centra principalmente en una de esas enfermedades llamada X frágil, que es causada por un CGG repetido. Sin embargo, ahora también está empezando a centrarse en la EH. ¡Guau!
Fragile X también tiene una expansión somática controlada por genes de reparación del ADN. Karen ha utilizado ratones que modelan el X frágil para identificar qué genes de reparación del ADN son importantes para este proceso en el X frágil. Karen se ha centrado en partes de la maquinaria de reparación del ADN llamadas complejos MutL.
Su laboratorio eliminó una parte del complejo MutL, llamado PMS2. La reducción de los niveles de PMS2 detuvo las expansiones repetidas en células humanas y de ratones con otras enfermedades genéticas. Encontró resultados similares con otra parte del complejo MutL llamada PMS1. La reducción de los niveles de PMS1 redujo las expansiones en Fragile X. Combinado con datos de otras enfermedades, esto sugiere que PMS1 desempeña un papel en la expansión en enfermedades repetidas.
Ahora Karen está llegando a lo bueno: ¡su trabajo en EH! Hizo un modelo de ratón que tenía genes tanto para la EH como para el X frágil. Con este ratón, pudo observar la expansión repetida en ambos genes al mismo tiempo. Quería saber si la expansión de un gen afectaba la expansión del otro gen. En pocas palabras: no. Las expansiones del gen de la EH no influyeron en el gen del X frágil y viceversa.
Ella sugiere que las expansiones dependen del equilibrio entre los diferentes tipos de maquinaria de reparación del ADN en diferentes células. Algunas de las ideas que propone son puramente teóricas, ¡pero invitó a otros científicos a conversar sobre ello mientras tomaban una bebida! Conferencias como ésta son un lugar fantástico para intercambiar ideas.
Rgenta Therapeutics: medicamentos orales dirigidos a la reparación del ADN
La última charla del día provino de Travis Wager de Rgenta Therapeutics. Travis nos habló de los medicamentos que su equipo está desarrollando y que pueden tomarse por vía oral para atacar el modificador PMS1, con el objetivo de frenar la expansión somática en ensayos clínicos en humanos.
Rgenta ha pasado los últimos cuatro años pensando en cómo perseguir objetivos que tradicionalmente se han considerado “no farmacológicos”. Otros han intentado atacar genes que controlan la expansión somática, como PMS1 y MSH3, en el pasado sin éxito. Los medicamentos de Rgenta actúan como pegamentos que crean un vínculo más fuerte entre los mensajes de ARN que causan enfermedades y las proteínas que se unen a ellos, para cambiar la forma en que se fabrican las proteínas o deshacerse de un mensaje o proteína defectuoso.
Travis destacó las diversas enfermedades a las que intentan atacar con sus medicamentos contra los genes que controlan la expansión somática. Esto incluye la EH, la distrofia miotónica, el X frágil y la ataxia de Fredreich: todas ellas enfermedades de expansión repetida. El interés de Rgenta en la EH está impulsado por la disponibilidad de enormes cantidades de datos tanto de humanos como de animales, un testimonio de la colaboración y dedicación de los científicos y las familias de la EH. Por este motivo, el campo de la EH atrae a muchas empresas.
Rgenta se ha centrado en el PMS1, porque los niveles más altos de PMS1 en las personas se asocian con una aparición más temprana de los síntomas de la EH. Utilizando ratones, han demostrado que cambiar los niveles de PMS1 parece seguro y no está asociado con el cáncer. Rgenta probó miles de sustancias químicas diferentes que se sabe que cambian los niveles de ARN y luego midió cuáles eran mejores para cambiar los niveles de PMS1, su objetivo. ¡Muy guay!
Su molécula farmacológica que se dirige a PMS1 es algo llamado “modulador de empalme”. Funciona alterando la molécula mensajera PMS1, lo que da como resultado niveles más bajos de la proteína PMS1. Han demostrado que su fármaco funciona en muchos modelos celulares y animales diferentes. Luego probaron su fármaco dirigido a PMS1 en células de EH cultivadas en una placa. En teoría, reducir el PMS1 debería reducir la expansión somática. ¡Y eso es exactamente lo que encontraron! Reducir el PMS1 en aproximadamente un 90% esencialmente detuvo la expansión somática.
El compuesto de Rgenta también parece apuntar realmente solo a los niveles de PMS1 sin afectar a otras proteínas. También compartieron datos que sugieren que el compuesto funciona bien en modelos animales y llega bien al cerebro. En este momento, Rgenta solo tiene datos que muestran que la reducción de PMS1 reduce las expansiones somáticas en las células de EH en un plato. Pero están avanzando con este enfoque y planean probar su fármaco en otros modelos de EH. Sin embargo, esta es una noticia emocionante, ya que significa que hay otro fármaco prometedor en proceso que algún día podría llegar a la clínica si los estudios en animales continúan teniendo buenos resultados.
¡Estamos muy felices de finalizar el Día 1 después de informar sobre tantas cosas interesantes que suceden en los laboratorios de universidades y empresas de todo el mundo! ¡Estén atentos al día 2, que llegará en breve!


