
Conferencia sobre Terapias en la enfermedad de Huntington 2020 – Día 3
HDBuzz informa desde la Conferencia anual sobre Terapias en la enfermedad de Huntington en Palm Springs


Rachel y Sarah informan desde la Conferencia sobre Terapias en la Enfermedad de Huntington, la mayor reunión anual de investigadores de EH.
Asegúrese de ponerse al día con el Día 1 y el Día 2.
Jueves por la mañana – Disminución de huntingtina
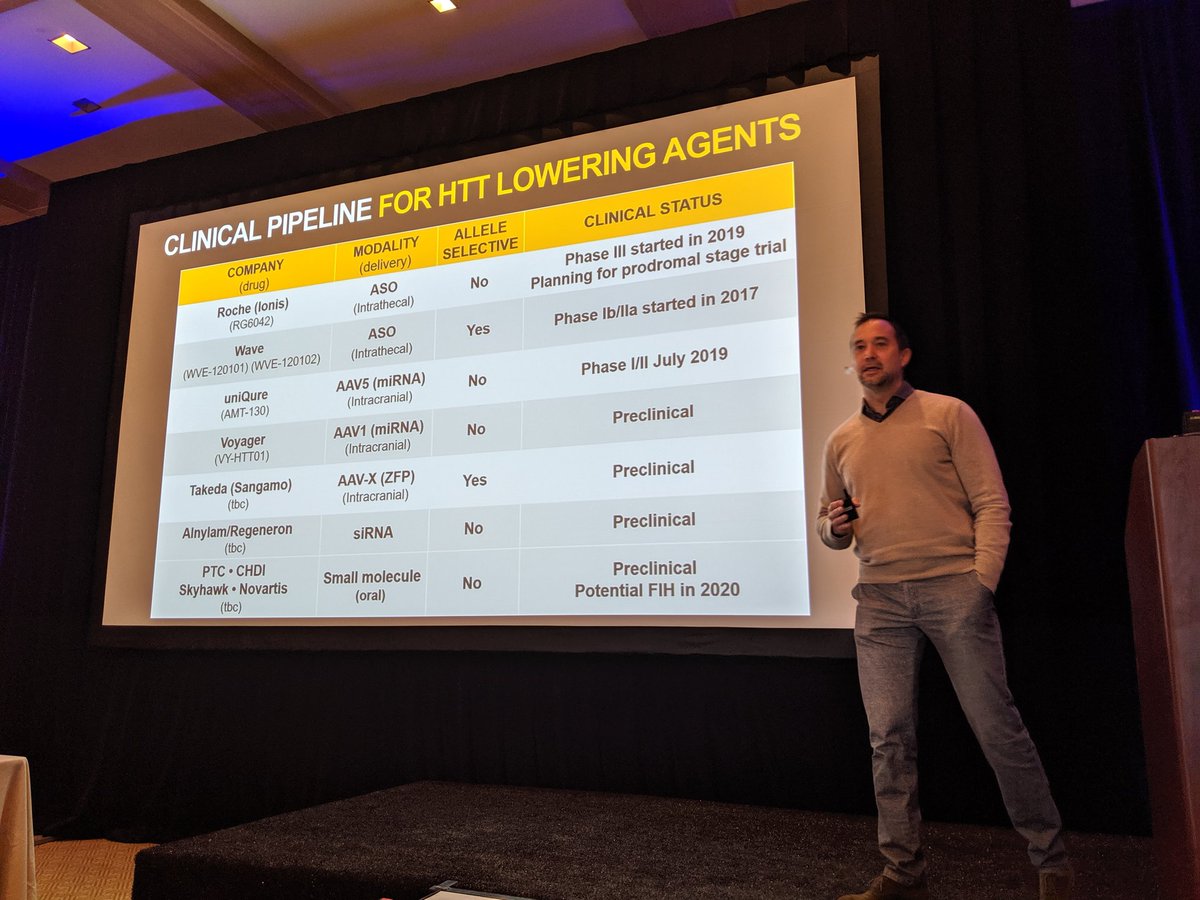
¡Buenos días a todos! Regresamos en el día 3 en la reunión de CHDI en Palm Springs, que trata de reducir la huntingtina. ¡Hay MUCHOS investigadores y compañías interesadas en bajar la huntingtina!
Sabemos que reducir la proteína huntingtina (HTT) en ratones y ratas ayuda a mejorar los síntomas y la progresión de la EH, y que es posible reducir la HTT en otros animales. Sin embargo, la pregunta del millón es si podemos reducir la HTT en humanos y si esto ayuda a tratar a los pacientes. Otras grandes preguntas son cuándo deberíamos reducir la HTT: ¿debemos hacer esto antes de que los pacientes muestren síntomas o más tarde? ¿Y necesitamos reducir la HTT en áreas específicas del cerebro? ¿O debería hacerse esto en todo el cerebro? Todas las cosas que los ensayos clínicos actuales están tratando de responder.
Podemos ser optimistas de que los ensayos clínicos nos ayudarán a responder estas preguntas. Los científicos han desarrollado muchas formas de tratar de reducir la HTT, así como todo tipo de herramientas para medir los niveles de HTT en el cerebro. También hay muchas estrategias alternativas en el camino.
Nuestro primer orador es Ignacio Muñoz-Sanjuan de CHDI, que habla sobre el mejor momento para aplicar las estrategias de reducción de HTT. Muñoz-Sanjuan también participa activamente en la atención de pacientes en América Latina. Muñoz-Sanjuan comenzó una organización sin fines de lucro que centra sus esfuerzos en la atención de pacientes, llamada Factor H.
Los científicos quieren asegurarse de que cualquier terapia que se desarrolle sea segura para los pacientes. La EH afecta a todo el cuerpo, por lo tanto, mientras nos centramos en la disminución de la HTT en el cerebro, es importante comprender los efectos del tratamiento en todo el paciente. La neurodegeneración es un problema difícil de abordar: los científicos en otros campos, como el Alzheimer y el Parkinson, también están preocupados por la mejor forma de tratar a los pacientes, no es una tarea fácil hacer estos nuevos medicamentos, por lo que debemos ser cautelosos para avanzar.
Un área atractiva para la reducción de HTT son las moléculas pequeñas. Estos son medicamentos que se tomarían en forma de píldora, por lo que muchas personas están bastante interesadas en desarrollar aún más esta estrategia. Pero esto probablemente no se centraría específicamente en la HTT expandida, sino en la HTT total. Una pregunta clave en la reducción de HTT es el momento: ¿cuándo deberíamos tratar para detener la enfermedad? ¿Podemos revertir cualquier daño que se haya hecho o podemos tratarlo en etapas posteriores de la enfermedad? Los investigadores no quieren dar medicamentos innecesarios a los pacientes si no tienen que hacerlo. El cerebro es un órgano realmente complejo y es importante recordar que, si bien los modelos de ratón son útiles para investigar algunos aspectos de la progresión de la EH, un cerebro de ratón no es un cerebro humano. Usar muchos modelos diferentes de EH es clave para estudiar cómo podrían funcionar los fármacos. Sin embargo, los ratones son críticos para avanzar en la investigación de la EH. Dado que el momento del tratamiento es un tema candente, los investigadores han seguido lo que sucede con la reversión de los efectos celulares en ratones. Muy emocionante, los investigadores están descubriendo que la disminución de HTT en ratones puede prevenir y revertir los déficits en las neuronas estriatales, el tipo celular más afectado en el cerebro de los pacientes con EH, ¡una noticia increíble!
Ahora, pasamos a los prometedores biomarcadores de la EH. Un resumen rápido de que éstas son las medidas que los científicos pueden hacer en los pacientes para rastrear cómo progresa la EH. Los buenos biomarcadores pueden ayudar a informar a los médicos sobre cómo y cuándo tratar mejor a los pacientes. CHDI ha pasado mucho tiempo desarrollando nuevas técnicas de imagen que nos permitirán visualizar cuánta HTT hay en el cerebro y dónde se encuentra. Para hacer esto, han desarrollado una nueva molécula que se une específicamente a la molécula de proteína HTT cuando se forma en ciertas estructuras agrupadas. Esto se llama marcador de PET o ligando de PET, porque los escáneres en los que aparece se llaman escáneres de PET, abreviatura de tomografía por emisión de positrones. La molécula puede cruzar al cerebro, por lo que podría usarse para ayudar a rastrear la disminución de HTT. Ya, CHDI y su equipo están midiendo la reducción de estos grupos de HTT en diferentes modelos de ratón EH. Están intentando reducir la HTT en diferentes áreas del cerebro del ratón y también están tratando ratones de diferentes edades.
Otra pregunta que los científicos están tratando de responder es ¿cuánto deberíamos reducir la proteína HTT en las células? ¿Qué nivel podría ayudar a tratar a los pacientes? ¿Qué niveles son seguros? Podemos usar el ligando de PET de la HTT y otros experimentos para medir los niveles de disminución después del tratamiento y luego podemos ver qué modelos de ratones se recuperan a qué niveles de disminución. Esto podría ayudar a traducir los descubrimientos de ratones a humanos.
El siguiente orador es Mark Bevan, de la Northwestern University, que habla sobre su trabajo para reducir la HTT en una región cerebral específica.
La investigación que Bevan comparte hoy con nosotros se centra en cómo la disminución de la HTT en ciertas áreas del cerebro podría cambiar la forma en que funciona el cerebro y cómo esto podría afectar los síntomas en los pacientes. Como muchos otros, Bevan está interesado en las diferencias específicas de un tipo de célula en la EH. Su grupo está descubriendo que algunos tipos específicos de neuronas son menos activos, mientras que otros parecen no verse afectados en los modelos de ratones con EH. Al observar los modelos de ratones EH, Bevan descubrió que existen diferencias en la forma en que las neuronas se comunican entre sí y está utilizando sus experimentos para analizar la comunicación de neurona a neurona para estudiar el efecto de la disminución de HTT en estos ratones. Al reducir la HTT en los ratones con EH, Bevan está viendo que mejoran los déficits motores: los ratones pueden moverse distancias más largas a una velocidad más rápida. Grandes noticias ya que los ensayos clínicos en humanos actuales aún no han revelado datos sobre los cambios que podrían estar viendo en los síntomas. Bevan y sus colegas continúan analizando la reducción de HTT en otros déficits motores y demás síntomas en sus modelos de ratones. Esperan que sus hallazgos puedan desvelar cómo las terapias de reducción de HTT podrían traducirse en la clínica.
¡La siguiente es Marcy MacDonald del Hospital General de Massachusetts, cuya charla se titula intrigantemente «los límites exteriores»! Del estudio Enroll-HD, los investigadores están descubriendo que existe mucha variabilidad que proviene de factores distintos a la longitud del CAG. Si bien este ha sido un gran hallazgo en el campo de la EH, realmente indica cuán compleja es esta enfermedad, a pesar de que conocemos la causa genética. Otro gran agradecimiento a todos los participantes de Enroll-HD. Espero que te hayas dado cuenta de que muchos investigadores están haciendo un gran uso de los datos que estás proporcionando, ¡gracias! Si bien todos tenemos el gen de la HTT y los pacientes con EH tienen un CAG más largo que otros, también tenemos otras pequeñas variaciones en la secuencia del gen HTT que los investigadores como MacDonald están interesados en estudiar y utilizar terapéuticamente.
El equipo de MacDonald ha generado montones de datos sobre lo que puede modificar la progresión de la enfermedad en la EH. Están compartiendo todos sus datos para que los científicos de todo el mundo puedan trabajar juntos en ellos: muchos pares de ojos siempre son mejores que uno. Por casualidad, MacDonald identificó personas que han reducido la expresión de HTT. Estas personas están bien, por lo que los investigadores saben que reducir la HTT al menos a ese nivel no debería tener efectos perjudiciales. Dado que los niveles de expresión de HTT varían dentro de la población y las personas parecen estar bien, esta es una buena noticia para las estrategias de reducción de HTT. Sugiere que alterar los niveles de HTT podría no tener efectos secundarios negativos. Sin embargo, una cosa a tener en cuenta es que cuando se reduce la HTT (específicamente en el hígado), las células son menos capaces de mantener el estrés en los modelos de ratón. De nuevo, es muy importante que los investigadores prueben la seguridad a fondo para todas las estrategias de reducción de HTT.
Debido a que los niveles de expresión de HTT varían dentro de la población, los investigadores también deben ser conscientes de que los niveles iniciales de HTT para pacientes en ensayos de reducción de HTT pueden diferir. Por lo tanto, uno podría imaginar en el futuro un enfoque más personalizado para cada paciente. Todos estos son puntos que las empresas que ejecutan pruebas de reducción de HTT están considerando en su diseño de prueba. Todos esperamos escuchar más actualizaciones de estos ensayos en la sesión de la tarde.
Jueves por la tarde – reducción de huntingtina en la clínica

¡Buenas tardes! Esta sesión se centra en traducir la reducción de HTT a la clínica. Nuestra primera charla es de Charlotte Sumner de Johns Hopkins. Ella expondrá algunos de los desafíos asociados con utilizar terapia génica.
Si bien Sumner se centra principalmente en una enfermedad neurodegenerativa diferente llamada atrofia muscular espinal (AME), actualmente hay un tratamiento ASO para la AME, por lo que el campo de la EH puede aprender mucho al observar lo que están haciendo. De manera similar a la EH, conocemos las causas genéticas precisas de la AME. Sin embargo, nuestra comprensión de lo que está sucediendo con las moléculas de proteína en la célula es mucho más confusa, por lo que los drivers de la enfermedad no están completamente claros. Debido a que la genética es clara, hay una serie de terapias genéticas diferentes que se han desarrollado para la AME. Además de una terapia ASO aprobada, también hay moléculas pequeñas (tomadas en una píldora) que reducen el gen, esto está actualmente en revisión en la FDA. También se ha demostrado que una dosis única o terapia de reemplazo génico de «una sola dosis» que fija la secuencia de ADN directamente funciona bien en niños pequeños con AME y se está trabajando para ver si este tratamiento funcionaría bien para pacientes adultos. Algunos pacientes en los ensayos de AME mejoraron drásticamente en varios aspectos que se midieron. Estos hallazgos son muy alentadores para el campo de la investigación en la EH, donde esperamos aplicar algunas de las estrategias exitosas que se han encontrado en el campo de la AME. Anteriormente en la conferencia, tuiteamos sobre investigadores que estaban interesados en determinar cuándo es el mejor momento para tratar la EH. En el campo de AMS, descubrieron que el tiempo realmente importa, por lo que es genial ver que la investigación de la EH está en el camino correcto.
Debido a que algunos pacientes con AME han respondido de manera diferente a los tratamientos, los investigadores de AME están interesados en obtener más datos del paciente para comprender las posibles razones de esta variación. Esto refuerza por qué los estudios como Enroll-HD serán útiles para la investigación de la EH. Ahora los investigadores de la AMS están tratando de encontrar la mejor manera de tratar y monitorizar a sus pacientes, es decir, ¿qué cantidad de medicamento deben administrar? ¿Cuándo y con qué frecuencia se debe administrar? Con suerte, esto debería mejorar aún más los resultados del paciente. Nuevamente, de manera similar a la EH, los investigadores de la AME están interesados en el neurofilamento como un biomarcador para la progresión de la enfermedad. Están monitorizando los niveles de neurofilamentos en pacientes que son tratados con diferentes terapias de AME y los niveles de neurofilamentos parecen disminuir con el tiempo con el tratamiento.
La próxima charla es de Anastasia Khvorova, que trabaja en la Facultad de Medicina de la Universidad de Massachusetts y nos hablará sobre la reducción de HTT utilizando una técnica llamada ARNi. Al igual que los ASO, las terapias basadas en ARNi se dirigen al mensaje de HTT en lugar del ADN o la proteína, actuando para destruir el paso intermedio para que la proteína nunca se produzca. Puede leer más sobre RNAi y cómo difiere de los ASO aquí.
Para probar cómo el ARNi dirigido a HTT afecta a la enfermedad, Khvorova y su equipo primero analizaron los efectos en ratones. El primer paso fue medir la difusión de su tratamiento en el cerebro, ¡resultados muy prometedores! Después del tratamiento, encontraron que la HTT se redujo significativamente en muchas áreas del cerebro. Este trabajo apuntó a HTT expandido y no expandido, pero también están trabajando en enfoques que se centrarán en el HTT expandido. Al hacer algunos ajustes inteligentes a las moléculas de ARNi, Khvorova y su equipo pudieron hacer que su tratamiento fuera selectivo sólo para el mensaje HTT expandido, de modo que sólo se redujera esta proteína, no la no expandida. Sin embargo, debe tenerse en cuenta que esto solo funcionará en ~ 35% de los pacientes que tienen una ligera diferencia en su secuencia génica de huntingtina llamada SNP (se pronuncia «snip»). Esto permite que el tratamiento con ARNi seleccione el HTT expandido y no el HTT no expandido. Luego, querían ver cómo funcionaba su tratamiento con ARNi en modelos animales más grandes, por lo que pasaron de ratones a ovejas. Utilizando ovejas, probaron varios métodos de administración del tratamiento y descubrieron que podían inyectarse en el cerebro o el LCR y funciona igual.
Después de las ovejas, Khvorova y sus colegas pasaron a monos y nuevamente vieron que el tratamiento con ARNi se difundía bastante bien por el cerebro y la médula espinal. Permanece en estas regiones durante bastante tiempo, por lo que no esperan tener que tratar con mucha frecuencia. En un estudio de seguridad muy inicial en estos monos, la terapia parece segura a la dosis probada. Del mismo modo, los primeros datos de un estudio de seguridad de ovejas mostraron que la terapia era segura en las condiciones que los científicos probaron. La noticia emocionante es que la HTT se reduce significativamente en estos primeros estudios en monos. Los niveles de otros genes parecen no haber cambiado, lo que significa que los efectos secundarios o fuera del objetivo parecen ser bajos utilizando la forma en que los científicos midieron en este experimento. Sin embargo, buscar incluso pequeños cambios en otros genes es realmente importante, por lo que Khvorova y sus colegas están trabajando para asegurarse de que no haya diferencias y confirmar la seguridad de esta terapia. Khovrova y sus colegas creen que esta tecnología es muy prometedora, así como CHDI. Podría usarse para cambiar los niveles de otras proteínas en el cerebro, como las identificadas como modificadores para la aparición de síntomas en pacientes con EH u otros objetivos. Una de las cosas a las que están prestando atención es el costo. Están tratando de mantener el costo bajo para que pueda estar ampliamente disponible para todos los pacientes con EH. ¡Estamos ansiosos por recibir más actualizaciones sobre esta prometedora investigación a medida que avanzan hacia la clínica!
Nuestro próximo orador es Astrid Valles-Sanchez de uniQure. Nos contará sobre el enfoque de uniQure para reducir la HTT. UniQure tiene un tratamiento llamado AMT-130 para reducir la HTT y actualmente está realizando un ensayo clínico para determinar la seguridad de este tratamiento. AMT-130 está diseñado para ser una inyección única que reduce la HTT en el cerebro. Valles-Sanchez está enfocando su discurso en los biomarcadores que están utilizando para medir la efectividad de este tratamiento para modificar la progresión de la enfermedad de Huntington. Utilizando un modelo de cerdo, han comprobado que su tratamiento sigue detectándose en el LCR a los 2 años. En los monos, detectaron el tratamiento a los 6 meses, cuando los animales fueron sacrificados. De manera similar a otros estudios, uniQure quiere verificar que su terapia se está difundiendo por el cerebro para ver dónde podría estar funcionando. En el modelo porcino 12 meses después del tratamiento, analizaron el tejido de diferentes áreas del cerebro para ver qué tan eficazmente el tratamiento redujo la HTT. Encuentran una disminución significativa de la HTT expandida con la disminución más fuerte en las regiones cerebrales más afectadas por la EH. UniQure también analizó los niveles de HTT expandidos en el LCR después de tratar los modelos EH de cerdo con AMT-130, pero en este experimento en particular, los niveles en el LCR no se correlacionan con los niveles de HTT encontrados en el cerebro. Los científicos de uniQure están interesados en utilizar la espectroscopía de resonancia magnética (MRS), una forma no invasiva de observar el cerebro, para ver si hay algún cambio en los productos químicos llamados metabolitos que se encuentran en diferentes áreas del cerebro después del tratamiento.
La charla final de la conferencia es de Scott Schobel, quien nos contará algunos nuevos resultados muy preliminares del ensayo de Roche. Estos resultados provienen de una extensión en fase abierta de 15 meses en pacientes con EH manifiesta (sintomática), debemos ser un poco cautelosos al interpretar estos datos pues son muy preliminares, pero no obstante es emocionante ver lo que encontraron.
¡Y eso es todo desde la Conferencia sobre Terapias en la EH de este año! Asegúrese de ponerse al día con el día 1 aquí y el día 2 aquí y mantenerse al día con la conversación en Twitter. Como muchos proyectos en el campo de la investigación en la EH, este ha sido un gran esfuerzo de colaboración de muchos investigadores que trabajan juntos para lograrlo. ¡RG6042 tiene un nuevo nombre! Se llama tominersen, que es como se llamará la terapia de ahora en adelante. Los pacientes en el estudio de seguridad original se mantuvieron en una fase de extensión abierta, lo que significa que después de que finalizó el ensayo de seguridad, continuaron recibiendo la terapia y los datos que veremos hoy es lo que los científicos han encontrado desde el final del estudio de seguridad. Resumen: esta terapia NO es selectiva para el gen HTT expandido, está diseñada para reducir los niveles de proteína de huntingtina expandida y no expandida. La gente de Roche y sus colaboradores han estado trabajando durante muchos años con diferentes modelos animales para determinar cuánto necesitarían para reducir los niveles de proteína huntingtina y cómo podrían medir esa disminución de la proteína observando el LCR. Hace dos años, en la reunión de CHDI, Sarah Tabrizi de UCL presentó los primeros resultados del estudio de seguridad. En solo 2 años hemos logrado grandes avances en la reducción de HTT con muchas estrategias disponibles ahora, ¡muy emocionante!
Según el estudio de seguridad, parecía que los niveles de proteína HTT podrían reducirse con tominersen de una manera dependiente de la dosis. Esto significa que la proteína se redujo más en pacientes que recibieron más tratamiento en el pequeño número de pacientes evaluados. La fase de extensión abierta probó 2 estrategias de dosificación: a los participantes se les dosificó cada mes o cada dos meses. Este tipo de diseño fue crítico para determinar con qué frecuencia habría que administrar tominersen a los pacientes. Encontraron que se observó una buena reducción de la huntingtina incluso cuando se administraba tominersen cada dos meses. Los dos grupos de pacientes tenían muy pocos participantes que no completaron este estudio de extensión. ¡Todos estamos agradecidos con estos pacientes por su compromiso con el ensayo! Dadas las métricas que Roche examinó, los datos indican que tominersen debe administrarse cada dos meses en lugar de cada mes. Debido a que descubrieron que la dosificación menos frecuente era efectiva para reducir la HTT, modificaron la estrategia para el siguiente brazo del estudio (Fase III) para reducir el número de dosis y las dosis de prueba cada 16 semanas, ¡mucho menos exigente para los pacientes!
Los niveles de neurofilamento, un biomarcador de EH propuesto para controlar la progresión de la enfermedad, podría ser útil para ver si es efectivo el tratamiento y Roche continúa investigando los niveles de neurofilamento en el ensayo clínico. Descubrieron que los niveles de NFL tienen un aumento inicial, pero las cantidades parecen disminuir e igualarse a los 15 meses. Roche está interesado en comprender aún más el biomarcador NfL y está investigando la biología subyacente que podría vincular HTT y NfL. Hay más trabajo clínico en trámite en Roche que, con suerte, continuará informando a los investigadores de la EH sobre la eficacia de esta terapia. Schobel ha compartido amablemente sus diapositivas en línea!
¡Y eso es todo amigos! Esperamos que estos tweets en directo hayan sido útiles para que todos los sigan, ¡ya estamos emocionados por el próximo año!


