Se describe una nueva e interesante herramienta para reducir la huntingtina
Nuevo e interesante trabajo de reducción de la huntingtina de @SangamoTx y @CHDIfoundation utilizando «dedos de zinc» para detener la expresión del gen de la huntingtina mutante. Más detalles sobre esta nueva e interesante técnica aquí.

Se acaba de describir una nueva e interesante herramienta en la lucha contra la enfermedad de Huntington. Un grupo internacional de científicos ha desarrollado una nueva forma, dirigida, de reducir los niveles de la proteína huntingtina mutante.
Genética de la huntingtina: del gen a la proteína
La enfermedad de Huntington (EH) está causada por un cambio genético – o mutación – en el ADN de un gen específico. Los científicos llaman al gen huntingtina. Como cualquier otro fragmento de ADN en nuestras células, el gen de la huntingtina se compone de cuatro letras químicas, que se repiten en patrones únicos que les dan sus funciones únicas.
Esas cuatro letras del ADN se denominan con abreviaturas de sus nombres químicos, ‘A’, ‘C’, ‘T’ y ‘G’. Todos los casos de EH están causados por un alargamiento de un tramo largo de las letras del ADN ‘C-A-G’ muy cerca del principio del gen de la huntingtina. En la mayoría de las personas -las que no están destinadas a desarrollar la EH- ese código ‘C-A-G’ se repite unas 20 veces, por razones que aún no entendemos del todo.
La EH surge cuando una persona hereda un tramo alargado de ‘C-A-G’, y la enfermedad aparece inevitablemente en personas que heredan 40 o más ‘C-A-G’. Tenga en cuenta que todo el mundo tiene dos copias diferentes del gen de la huntingtina: una heredada de la madre y otra del padre. La gran mayoría de los pacientes con EH tienen una copia normal con un número bajo de ‘C-A-G’, y la copia mutante en la que son más largos.
La mayoría de los genes, incluido el gen de la huntingtina, son utilizados por las células como manuales de instrucciones para construir proteínas: diminutas máquinas moleculares que ayudan a las células a realizar su trabajo. Así, en las células de las personas con la mutación de la EH, hay dos versiones diferentes del gen de la huntingtina, y esas instrucciones le dicen a la célula que produzca dos versiones diferentes de la proteína huntingtina.
Reducción de la huntingtina
Un objetivo importante del mundo de la investigación de la EH actualmente es investigar si las estrategias de «reducción de la huntingtina» podrían ser tratamientos eficaces para la EH. El objetivo de los tratamientos de reducción de la huntingtina es detener, o ralentizar, la velocidad a la que las células utilizan la información del gen de la huntingtina para producir la proteína huntingtina.
Los estudios en animales sugieren que si podemos reducir la cantidad de proteína huntingtina producida a partir del gen de la huntingtina mutante, podemos tener la esperanza de reducir los síntomas de la EH. Varias compañías farmacéuticas están utilizando una amplia gama de enfoques para reducir la huntingtina como tratamientos potencialmente nuevos para la EH. Hemos cubierto la idea general de la reducción de la huntingtina aquí, con actualizaciones más recientes sobre los fármacos de reducción de la huntingtina llamados ASOs aquí y aquí, y otros enfoques aquí y aquí.
Y ahora, los ZFP
La empresa de biotecnología Sangamo Therapeutics lleva varios años trabajando en otra forma de reducir las proteínas: controlando si un gen se activa o no. Su tecnología se basa en pequeñas máquinas moleculares llamadas
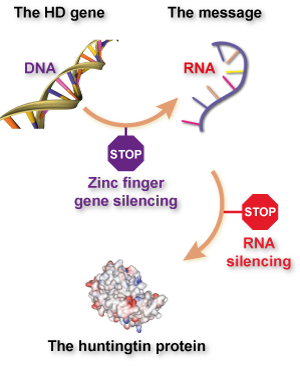
Aunque la idea básica es la misma, los ZFP funcionan de una forma bastante singular, en comparación con las tecnologías de reducción de la huntingtina existentes. Los fármacos de reducción de la huntingtina existentes actúan sobre un paso intermedio entre la lectura de la información del gen de la huntingtina del ADN y la producción de la proteína huntingtina. La información de los genes se lee primero del ADN, se copia en un lenguaje estrechamente relacionado llamado ARN y luego se traduce al lenguaje de las proteínas. Este mensaje intermedio de ARN es el objetivo de los fármacos de reducción de la huntingtina que se encuentran actualmente en la clínica.
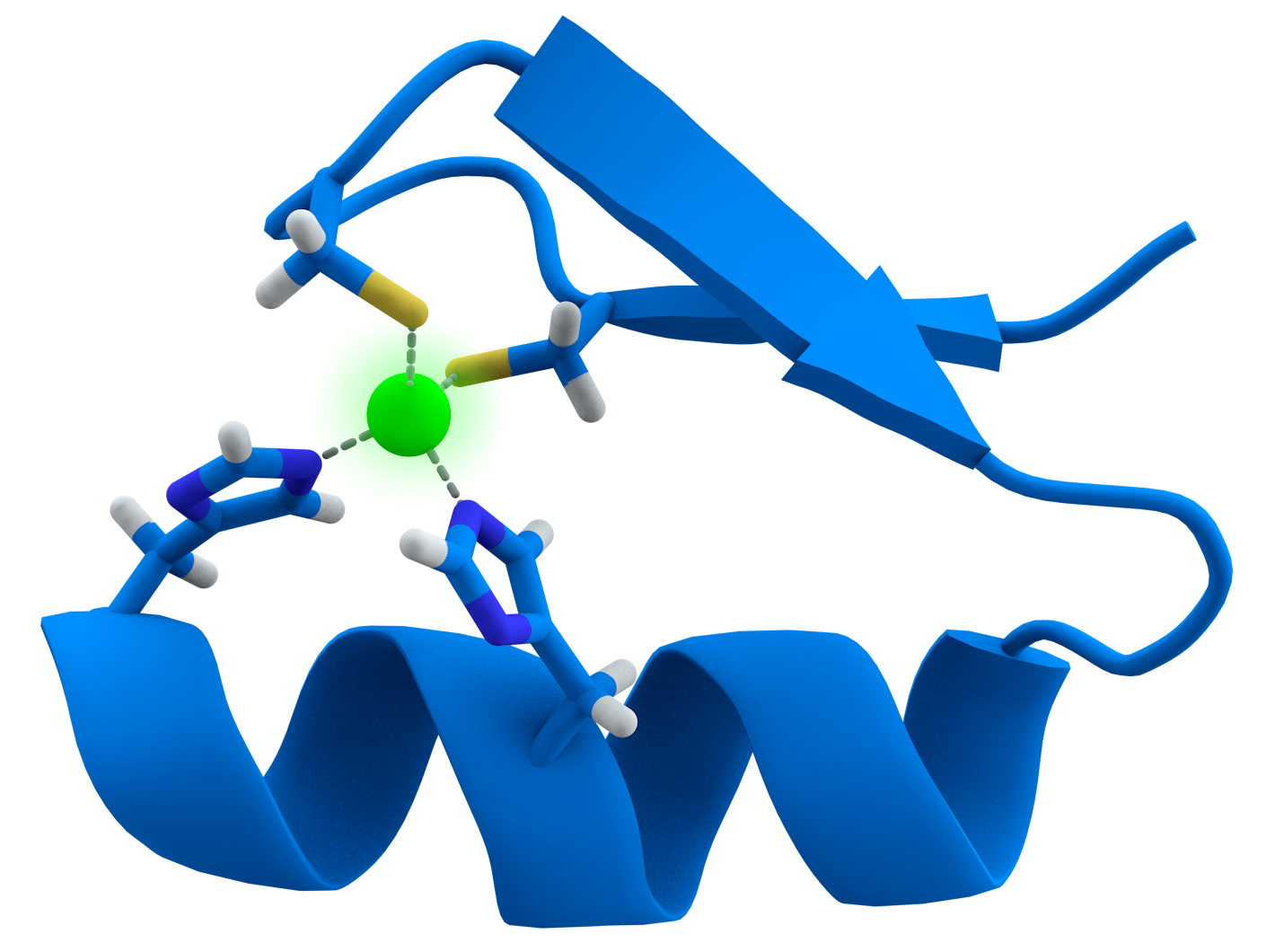
Pero los ZFP, como los desarrollados por Sangamo y sus colaboradores, funcionan de una forma muy diferente. Nuestras células contienen una serie de proteínas que incluyen pequeñas pinzas, que tienen la forma adecuada para agarrar secuencias de ADN específicas. (Alerta para nerds: las pinzas se mantienen unidas por un átomo de zinc, lo que explica el nombre divertido).
«A diferencia de los enfoques que se dirigen al ARN de la huntingtina, las células tratadas con ZFP nunca activan su gen de la huntingtina en primer lugar».
¿ZFP para la EH?
Durante muchos años, los investigadores han trabajado para comprender los ZFP naturales con la esperanza de poder reprogramarlos para que se adhieran a nuevas secuencias de ADN específicas. Sangamo ha sido un líder en este campo, y ha desarrollado una especie de kit de herramientas de ZFP personalizados que pueden dirigirse a casi cualquier secuencia de ADN.
¿Por qué hacer esto, cuál es el objetivo de fabricar pinzas de unión al ADN personalizadas? Pues bien, resulta que podemos adjuntar varias cargas útiles a estas pinzas, y algunas de ellas hacen cosas muy interesantes al ADN donde se adhieren. Por ejemplo, los investigadores saben que pueden fusionar una especie de señal de stop celular a los dedos de zinc, para impedir que la célula active el gen al que se dirigen.
Una publicación reciente describe el trabajo de Sangamo en el desarrollo de ZFP para su uso en la EH, que fue una colaboración a gran escala con la fundación CHDI y varios investigadores de la EH de todo el mundo. Tras un laborioso esfuerzo de selección, pudieron desarrollar nuevos ZFP que se adhieren al gen de la huntingtina -en el ADN- y bloquean su activación. Así, a diferencia de otros enfoques que se dirigen al ARN de la huntingtina, las células tratadas con estos ZFP nunca activan su gen de la huntingtina en primer lugar.
Aún mejor, el equipo pudo desarrollar ZFP que pueden desactivar la expresión de sólo la copia mutante del gen de la huntingtina, dejando la copia normal completamente sola. Sangamo probó su capacidad para discriminar entre uno de los tamaños de CAG más bajos que causan la EH en humanos (38 repeticiones de CAG), dejando sola la copia normal de la huntingtina.
Resultados prometedores en ratones
Después de demostrar en células que sus nuevos ZFP podían desactivar la huntingtina mutante específicamente, el equipo realizó a continuación una serie de estudios en animales muy bien realizados para ver si su herramienta podría ser útil en los cerebros de animales que tienen mutaciones similares a la EH. Para ser exhaustivos, probaron dos modelos animales diferentes de EH: uno con síntomas de progresión muy rápida y otro con cambios a largo plazo más sutiles.
En ambos casos, la administración de ZFP a los cerebros de los ratones condujo a reducciones de la proteína huntingtina. También ayudó a algunos de los síntomas que experimentan estos ratones, que se parecen un poco a las cosas que observamos en los pacientes con EH.
Es razonablemente fácil probar fármacos experimentales como este en ratones. Los investigadores pueden recoger tejido cerebral de animales y estudiarlo intensamente, pero estudios similares son imposibles en pacientes humanos con EH, que se ponen bastante gruñones si se les quitan trozos de cerebro. Debido a que la traducción de los estudios en ratones a los humanos es tan difícil, el equipo realizó otro conjunto de experimentos para determinar si el tratamiento con ZFP mejoraba las cosas de una manera que también podemos medir en las personas.
De hecho, utilizando sofisticadas técnicas de escaneo cerebral, el equipo pudo observar los beneficios del tratamiento con ZFP en ratones con EH. Estas técnicas bien establecidas también funcionan en humanos, por lo que si queremos probar los ZFP en estudios en humanos, podemos esperar buscar mejoras sin necesidad de extirpar tejido.

¿Cuáles son los riesgos y beneficios de los ZFP?
Como con cualquier otro tratamiento potencial para la EH, existen beneficios y desventajas en el uso de ZFP. En teoría, es un enfoque mucho mejor para detener la producción de proteínas de un gen mutante por completo, en lugar de tratar de limpiar el ARN y la proteína después. No entendemos completamente qué especies de ARN y proteínas tienen efectos tóxicos en las células, por lo que cerrarlo en el grifo parece ser el mejor enfoque.
Además, los datos presentados por Sangamo y sus colaboradores muestran una capacidad muy buena para discriminar entre la copia normal del gen de la huntingtina y la copia mutante. Silenciar sólo la copia mutante del gen de la huntingtina y no tocar la otra copia es, en teoría, preferible, ya que todavía no conocemos todos los riesgos asociados a la reducción de la copia normal.
En el lado negativo, los ZFP desarrollados por Sangamo y sus colaboradores son genes en sí mismos, codificados en el ADN, que deben ser entregados a cada célula que queramos tratar. El uso de la administración de genes para tratar una enfermedad se conoce generalmente como terapia génica. Para ser un tratamiento eficaz para la EH, la terapia génica con ZFP requerirá ciertas intervenciones. El ADN que codifica los ZFP debe empaquetarse en un virus e inyectarse en el cerebro.
Como cualquier fármaco, los ZFP desarrollados por Sangamo y sus colaboradores podrían tener consecuencias inesperadas. En este caso, la preocupación más simple acerca de los ZFP podría ser que accidentalmente se dirijan a otros genes – además de la huntingtina – para su reducción. El equipo llevó a cabo investigaciones bastante detalladas de esta posibilidad en las células, pero por supuesto en el cerebro las cosas podrían ser más complicadas.
La mejor manera de determinar si estos ZFP son tan útiles como esperamos es realizar estudios en humanos. Para apoyar esto, Sangamo ha establecido una asociación con el gigante farmacéutico japonés Takeda, que sin duda tiene la experiencia y los recursos para llevar a cabo tales estudios. Estén atentos a HDBuzz para cualquier anuncio sobre futuros estudios con ZFP en pacientes con EH.
Conclusión
Este nuevo e interesante estudio proporciona otra flecha en nuestro carcaj mientras abordamos la reducción de la huntingtina en la clínica. El estudio fue muy bien realizado, y nos deja bien posicionados para considerar la posibilidad de probar los ZFP en estudios clínicos en humanos. Es muy emocionante ver que brillantes científicos de todo el mundo siguen desarrollando nuevos enfoques para el tratamiento de la EH.
Estos nuevos ZFP parecen proporcionar beneficios interesantes en comparación con otros enfoques de reducción de la huntingtina que esperamos ver probados en pacientes con EH. ¡Estén atentos a HDBuzz para obtener más información sobre las terapias de reducción de la huntingtina!


