Silenciamiento del gen de la EH: la historia hasta ahora
¿Es el silenciamiento del gen tan prometedor como parece para la EH, y qué nos depara el futuro?
 Por Professor Ed Wild 20 de agosto de 2011 Editado por Dr Jeff Carroll Traducido por Asunción Martínez Publicado originalmente el 22 de marzo de 2011
Por Professor Ed Wild 20 de agosto de 2011 Editado por Dr Jeff Carroll Traducido por Asunción Martínez Publicado originalmente el 22 de marzo de 2011
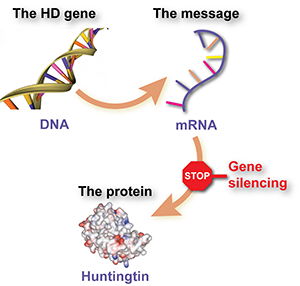
El silenciamiento del gen significa la utilización de molécules especialmente diseñadas para “apagar” el mensaje que utilizan las células para la formación de la proteína huntingtina dañina. Nuestro especialista de HDBuzz sobre silenciamiento del gen explica las técnicas, los resultados hasta ahora y los retos futuros.
Hemos tenido muchas peticiones de nuestros lectores para que escribamos un artículo sobre el “silenciamiento del gen” - también conocido como el “silenciamiento de la huntingtina”. Este es un área de investigación que genera mucha expectación. Muchas personas han mostrado interés por este tema a raíz de un reciente comunicado de prensa de Lundbeck y de la Universidad de Massachussetts, en el que se anuncia un proyecto de colaboración con el objetivo de desarrollar un “ARN de interferencia (ARNi)” como tratamiento para la EH.
Entonces, ¿qué es el silenciamiento del gen? ¿Cómo funciona? y ¿cómo puede ayudar a los pacientes con EH?

Los genes, las proteínas y los mensajes
Las proteínas son moléculas que actúan como pequeñas máquinas, llevando a cabo la mayor parte del trabajo útil dentro de las células - como la fabricación de productos químicos, la comunicación de mensajes, dando estructura a las células y así sucesivamente. Cada proteína se forma a partir de una serie de instrucciones contenidas en el gen. Los genes se forman a partir del ADN, y viven en el centro de control de la célula, el núcleo.
Sin embargo, los genes no hacen las proteínas directamente. Entre medias, la célula utiliza una secuencia de ADN del gen como plantillapara hacer una “molécula mensajera” llamada “ARN mensajero” o ARNm. La molécula mensajera de ARNm se utiliza para decirle a la célula qué bloques ha de utilizar para construir las moléculas de proteína.
En resumen, el ADN se utiliza como molde para hacer el ARNm y la molécula mensajera se utiliza para construir las moléculas de proteína.
La enfermedad de Huntington está causada por un único gen anormal - el gen que le dice a las células que fabriquen la proteína llamada huntingtina. Cada célula tiene dos copias de cada gen. La mayoría de los pacientes con EH o los portadores de la enfermedad, tienen un gen “normal” y otro con demasiadas repeticiones de la secuencia CAG al principio del gen. Este sencillo “error de escritura” da como resultado una proteina “mutada” que actúa de manera diferente a como lo hace la proteína normal y daña las células produciendo los síntomas de la EH.
Quizá haya oido el término “salvaje” - que es como los investigadores denominan al gen y a la proteína no mutada o “normal”.
Silenciar el gen de la huntingtina
Dado que el gen anormal es la causa de todos los problemas en la EH, ¿por qué no deshacerse de él y reemplazarlo con un gen sano? Desafortunadamente eso es poco probable que funcione, porque las células tienen muchas medidas de seguridad para proteger el ADN y evitar daños o alteraciones.
Por otro lado, la molécula de ARN mensajero está en la célula y mientras esté allí se podría utilizar para hacer más moléculas de proteína. Si pudiéramos decirle a la célula que ignore el mensaje erróneo, no se produciría más proteína dañina. Este es el principio detrás del “silenciamiento del gen”. La idea es crear un fármaco que sería en realidad una molécula especialmente diseñada para pegarse al mensajero de la huntingtina y que le diría a la célula que se deshaga de ella.
El silenciamiento del gen suena demasiado bien como para ser verdad, pero no es así. En 1998 dos investigadores que ganaron el Premio Nobel de Medicina, buscaron la forma de desactivar un único gen. Ellos llamaron a su técnica ARN de interferencia * (ARNi).
El silenciamiento del gen es actualmente una técnica estándar utilizada por los científicos para estudiar cómo actúan los organismos, cómo producen daño las enfermedades y como una forma para desarrollar tratamientos. Uno de los fármacos para silenciar genes (Vitravene, que se utiliza para tratar una infección vírica del ojo) está autorizado para su uso en humanos, y más de una docena de ensayos están en curso en muchas enfermedades diferentes, y muchos otros se llevarán a cabo.
Si fuera así de fácil, ya tendríamos píldoras silenciadoras del gen para la EH, así que, ¿cuál es el truco? Bueno, como con cualquier nueva técnica siempre se presentan nuevos desafíos, reveses y obstáculos inesperados en el camino.
Primer reto: entrar en el cerebro
Uno de los principales problemas es conseguir que las moléculas silenciadoras lleguen a donde son necesarias. En la EH el principal problema es la muerte de las células cerebrales llamadas neuronas, por lo que necesitamos introducir la molécula en dichas células.
«Muchos grupos distintos de investigadores han publicado resultados positivos en la disminución de la producción de la huntingtina en modelos animales »
El primer obstáculo es conseguir que el fármaco entre en el cerebro. El cerebro tiene un escudo de defensa natural para evitar que sustancias nocivas entren en la sangre. Eso es bueno para nosotros en general, ya que protege el cerebro, pero para los investigadores de fármacos para la EH es un dolor de cabeza, ya que resulta mucho más difícil conseguir que los fármacos entren en el cerebro que en, por ejemplo, el hígado o los riñones.
Por lo que es poco probable que una simple pastilla o una inyección sea capaz de combatir la EH silenciando el gen. Una de las formas de evitar este problema es utilizar pompas, bombas o pequeños tubos para infundir los fármacos silenciadores del gen directamente en el cerebro o en el líquido que lo rodea - el líquido cefalorraquídeo o LCR. Esto suena bastante desalentador, y no hay duda de que las bombas de infusión o los tubos en el sistema nervioso son un gran problema, pero ya se están utilizando sistemas similares para administrar medicamentos en otras enfermedades como la esclerosis múltiple (EM) y el cáncer cerebral, donde se ha conseguido un nivel de seguridad muy bueno.
Desafío dos: la distribución
Una vez que el fármaco está en el sistema nervioso, sigue sin resolverse el problema de la distribución. El cerebro es una pelota densa de tejido en donde es dificil que se esparzan las moléculas silenciadoras. Además el tratamiento ha de llegar dentro de las células para ser eficaz - si se queda entre las células no es suficiente.
Los científicos están utilizando diferentes métodos para resolver este problema. Los ganadores del Premio Nobel utlizaron moléculas de ARN de interferencia (ARNi) para silenciar los genes. Estas son muy similares a las moléculas producidas de manera natural por las células. La desventaja es que no tienden a expandirse de manera natural en todo el cerebro y no consiguen entrar dentro de las células fácilmente.
Por lo tanto, los investigadores del ARNi utilizan unos tubos muy finos insertados en la sustancial cerebral, dirigidas a las regiones más afectadas, conectados a unas bombas de presión para hacer llegar los fármacos más lejos. Otra opción es dejar a las moléculas de ARNi que “monten” dentro de virus desactivos, los cuales son expertos en dispersarse en el cerebro y en inyectar el material dentro de las células.
Otro enfoque es probar con moléculas diferentes que se distribuyan mejor dentro del cerebro y que entren dentro de las células. Los oligonucleótidos antisentido (ASOs) son similares a las moléculas de ARNi, pero son un poco más simples y no son producidas de forma natural por las células. El principio es el mismo - se adhieren a la molécula del mensaje del ARNm y evitan que la célula los utilice para construir proteínas.
Parece que los ASOs se difunden mejor por el cerebro y que pueden entrar en las células con bastante facilidad. También parece que viven más tiempo - lo que puede ser algo bueno o malo, dependiendo de lo bien que hagan su trabajo.
¿Qué técnica de silenciamiento del gen es mejor? No lo sabemos, por lo que estamos trabajando con el ARNi y con los ASOs al mismo tiempo, para ver cuál es mejor.
Reto tres: desactivar el gen
La prueba fundamental para el tratamiento mediante silenciamiento del gen es saber si puede desactivar el gen con éxito. Hasta ahora la investigación con modelos animales sugieren firmemente que así es, tanto con el tratamiento con ARNi como con ASO.
En 2005, un equipo de investigadores liderados por Bev Davidson en Iowa inyectaron moléculas ARNi en los cerebros de ratones EH y consiguieron una reducción del 85% del mensaje de la huntingtina. La función motora y las alteraciones celulares del ratón también mejoraron. Desde entonces muchos grupos diferentes de investigadoes han publicado resultados exitosos en la disminución de la producción de la huntingtina utilizando muchas moléculas diferentes, incluyendo fármacos con ARNi y con ASO. El trabajo más actual sugiere que incluso pequeñas infusiones producen beneficios mantenidos durante largos períodos de tiempo.
Cuarto desafío: la elección del objetivo adecuado
A los investigadores que desarrollan fármacos les gusta adelantarse a los problemas y no esperar a que aparezcan y un posible problema con el silenciamiento del gen es su efecto sobre la copia normal o salvaje del gen de la huntingtina.
Sabemos que no tener nada de huntingtina es peligroso. Los ratones sin ninguna copia del gen mueren antes de nacer. Así que la pregunta clave es si la disminución de la huntingtina mutante necesaria para el tratamiento de la enfermedad produce también una peligrosa reducción en la huntingtina normal?
De momento no lo sabemos. Algunos investigadores creen que pequeñas reducciones de la huntingtina mutada son suficientes para que las células tengan la oportunidad de recuperarse, por lo que no es necesario preocuparse por los efectos dañinos de una disminución de la proteina normal. Otros creen que necesitamos desarrollar tratamientos que sean capaces de desactivar el gen mutado sólo. A esto se le llama silenciamiento específico de alelo - un alelo es como llamamos a cada una de las copias de un gen.
El silenciamiento específico de alelo suena muy sensato - si somos capaces de centrarnos en el gen mutado, ¿por qué no íbamos a poder? La desventaja es que para centrarnos en una sola copia de un gen, hay que buscar en el ADN de cada paciente las diferencias de “deletreo” individuales entre los dos alelos. Afortunadamente, estas diferencias son frecuentes, pero probablemente se necesitarían varios fármacos distintos para ser capaces de proporcionar un tratamiento específico para tantos pacientes como sea posible. Algunos pacientes no tienen diferencias de deletreo adecuadas para poder ser tratados de esta manera.
El debate sobre si es necesario el tratamiento de silenciamiento específico de alelo está sobre la mesa, pero las buenas noticias son que no vamos a tener que esperar más tiempo para tener una respuesta, ya que ambas técnicas se están probando en este momento por distintos grupos de investigación.
Desafío cinco: los efectos secundarios
Los tratamientos mediante el silenciamiento del gen puede que tengan efectos secundarios, aparte del posible problema de la disminución de la proteína normal.
Uno de los problemas es el llamado “efectos del objetivo”, cuando la molécula terapéutica se une o interfiere con otras moléculas mensajeras distintas a las de la huntingtina. Esto podría generar un gran número de problemas.
Otro tema es el relativo al sistema inmune del cerebro que podría generar una lucha contra el “invasor”, es decir, las moléculas que se inyectan en él y que podría empeorar las cosas.
Ahora tenemos que considerar muy seriamente los distintos efectos secundarios mientras todavía se están probando en animales. Incluso un efecto no esperado relativamente inocuo puede ser una mala noticia, sobre todo si finalmente se utiliza el silenciamiento del gen durante muchos años para prevenir los síntomas de las personas portadoras.
Los científicos están trabajando para fabricar las mejores moléculas con los menores efectos secundarios y sólo las más seguras serán probadas en ensayos clínicos.
¿Cuándo, cuándo, cuándo?
El entusiasmo por el silenciamiento del gen está justificado, ya que muchos investigadores creen que es nuestra mejor oportunidad para la producción de tratamientos eficaces para la EH. Es evidente que hay un montón de temas que resolver, pero cada año vamos realizando progresos y todos concuerdan en afirmar que no hay nada que sugiera que la técnica no funcionará en pacientes.
En este momento se está llevando a cabo una prueba de silenciamiento del gen con ASO en pacientes con esclerosis lateral amiotrófica (enfermedad de motoneurona). Eso es muy importante porque no sólo se está probando el fármaco, sino también el sistema de infusión mediante una bomba y un tubo para conseguir que el fármaco alcance su objetivo. Mientras tanto, muchos investigadores en todo el mundo están pensando qué moléculas serán las mejores para ponerlas a prueba en pacientes con EH. No sabemos a ciencia cierta cuándo estarán disponibles los tratamientos de silenciamiento del gen para los pacientes, pero HDBuzz espera ver ensayos clínicos con pacientes con EH utilizando el silenciamiento del gen en un futuro muy cercano.