Conocer al enemigo: Los haces de neutrones muestran la estructura de la proteína de la EH
Los científicos usan haces de neutrones para estudiar la estructura de los agregados de la proteína huntingtina mutad
 Por Dr Jeff Carroll 29 de diciembre de 2011 Editado por Professor Ed Wild Traducido por Asunción Martínez Publicado originalmente el 26 de mayo de 2011
Por Dr Jeff Carroll 29 de diciembre de 2011 Editado por Professor Ed Wild Traducido por Asunción Martínez Publicado originalmente el 26 de mayo de 2011
La proteína huntingtina mutada forma grumos, o agregados, en las células cerebrales. Muchos científicos creen que estos agregados contribuyen a la muerte de estas células y a los síntomas de la EH. Los científicos han utilizado haces de neutrones para estudiar la formación de las estructuras de estos agregados.
Enfermedad de Huntington, Huntington, Huntingtina …
Los términos utilizados para describir la enfermedad de Huntington pueden resultar confusos. La EH está causada por una mutación en un gen llamada “huntingtina”. Los genes se utilizan como planos en las células para fabricar proteínas. Las proteínas se utilizan como elementos estructurales en las células y también son como pequeñas máquinas que realizan la mayor parte del trabajo de la célula.
El gen de la huntingtina es el que da las instrucciones para fabricar la proteína huntingtina. Y es la proteína huntingtina la que en realidad provoca la EH y no la mutación genética en sí misma. El trabajo fundamental de los investigadores de la EH hoy en día es entender cómo la proteína huntingtina mutada provoca los síntomas de la EH.
Agregados en el cerebro
En 1997 dos grupos de científicos aportaron pruebas de que la proteína huntingtina tiene tendencia a pegarse a sí misma formando agregados de proteínas. Un equipo dirigido por el Dr. Erich Wanker de Berlín encontró que la proteína huntingtina purificada en un tubo de ensayo forma pegotes (o “agregados”). Curiosamente, esto sólo ocurría con la proteína huntingtina mutada como en la enfermedad.
Al mismo tiempo, un grupo liderado por los Drs. Marian DiFiglia y Aronin Neil en el Hospital General de Massachusetts de Boston describió agregados muy similares en el cerebro de los pacientes humanos que habían muerto por la EH - lo que sugiere que el proceso de aglutinación puede ser relevante para la enfermedad.
Durante los 14 años que han transcurrido desde estos descubrimientos fundamentales, ha habido un gran debate entre los investigadores sobre lo que hacen estos agregados en la enfermedad de Huntington. Y no sólo en la EH - los agregados de proteínas también se encuentran en pacientes con otras enfermedades neurodegenerativas como el Alzheimer y la enfermedad de Parkinson.
Algunos científicos creen que estos agregados son simplemente el subproducto de las células del cerebro que se están muriendo. Otros creen que estos agregados son los que matan las células cerebrales y provocan la enfermedad - y por lo tanto vale la pena estudiarlos en detalle. Estos científicos creen que entender el primer paso del proceso de “agregación” nos dará pistas sobre cómo la proteína huntingtina mutada mata las células.
¿Un rayo de neutrones? ¿En serio?
«Este tipo de experimentos son excelentes para resolver debates científicos sobre la naturaleza de los agregados de huntingtina, pero hay un largo camino entre estas observaciones científicas y las nuevas terapias para la EH »
Estudiar el proceso de agregación de la huntingtina es muy difícil, porque cada una de las moléculas de proteína son muy pequeñas. Son tan pequeñas que los microscopios tradicionales no tienen capacidad suficiente para verlas.
Les presento a los neutrones. Los neutrones son partículas sub-atómicas diminutas que normalmente se encuentran en el centro de los átomos - es una de las partes más pequeñas de la materia. Algunas reacciones nucleares pueden producir haces de neutrones y estos rayos pueden pasar a través de una muestra de tejido. El material de la muestra “se dispersa” bajo el rayo - como una especie de haz de luz cuando atraviesa un vaso de agua.
Estudiando la forma de dispersión de los haces los científicos pueden saber Mediante el estudio de los patrones en el haz disperso, los científicos pueden conocer propiedades del material. Esto es un poco como deducir la forma de alguien mediante el examen de su sombra. Es útil, porque los haces de neutrones son capaces de crear unas sombras muy detalladas de unos objetos muy pequeños - como las proteínas.
Pero los haces de neutrones creados a partir de una reacción nuclear no son precisamente fáciles de conseguir - así que ¿cómo podemos usarlos para estudiar la EH? Un equipo dirigido por la Dra. Valerie Berthelier tuvo acceso a una fuente de rayos de neutrones de Oak Ridge National Laboratory, en Tennessee. Es el haz de neutrones más potente de los Estados Unidos.
Para poder estudiar los agregados de la EH en detalle, el equipo de Berthelier hizo gran cantidad de pequeñas muestras de la proteína huntingtina - la proteína mutada que produce la enfermedad de Huntington. Colocaron esta proteína huntingtina purificada bajo el haz de neutrones, y observaron el proceso de agregación en tiempo real.
Y ¿cómo se produce la agregación?
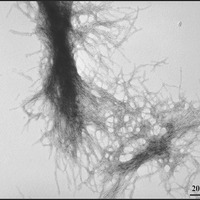
El equipo de Berthelier demostró que la proteína huntingtina purificada formó agregados muy rápidamente, como ya habian demostrado otros investigadores antes. En pocas horas, todas las proteínas se habían unido formando agregados. A continuación, utilizaron una técnica diferente - llamada microscopía electrónica para estudiar los agregados, que parecían una especie de material fibroso como era de esperar - como trozos de cuerda.

La ventaja de utilizar la técnica de los haces de neutrones es que permite estudiar los agregados desde que son muy pequeños. Ellos creen que dos o tres moléculas de la proteína huntingtina se unen para formar una pequeña esfera. Estas esferas se convierten rápidamente en largas cuerdas formadas por fibras de proteína huntingtina, trenzadas entre sí.
Limitaciones y conclusiones
La proteína huntingtina es muy grande - es seis veces más grande que el tamaño medio de una proteína de la célula humana. Eso hace que sea difícil estudiarla, porque las proteínas grandes son difíciles de manejar en el laboratorio.
Debido a estas dificultades, muchos científicos trabajan con pequeños trozos de la proteína huntingtina. En los experimentos descritos aquí se usa un pequeño fragmento que en realidad sólo es el primer 1% de la proteína huntingtina. Al trabajar con un fragmento tan pequeño se ignoran deliberadamente las cosas más complejas que ocurren en las células, donde está presente la proteína entera junto con muchas otras proteínas.
Además, dado que estas mediciones son tan difíciles de realizar es necesaria una gran cantidad de la proteína huntingtina - mucha más de la que normalmente se encuentra en las células. No está claro si lo observado en este estudio es lo mismo que lo que ocurre en las células, donde la cantidad de huntingtina es mucho menor.
Este tipo de experimentos son excelentes para poder resolver los debates científicos sobre la naturaleza de los agregados de la huntingtina y es emocionante ver tecnologías avanzadas aplicadas al estudio de la EH. Sin embargo, debido a las limitaciones descritas, hay un largo camino entre estas observaciones científicas básicas y las nuevas terapias para la EH.