Re-dirigiendo a la proteína huntingtina dentro de la célula
Un equipo de Canadá decodifica las señales que dirigen la huntingtina en la célula lo que explica cómo se vuelve tóxi
 Por Dr Jeff Carroll 5 de enero de 2012 Editado por Professor Ed Wild Traducido por Asunción Martínez Publicado originalmente el 26 de junio de 2011
Por Dr Jeff Carroll 5 de enero de 2012 Editado por Professor Ed Wild Traducido por Asunción Martínez Publicado originalmente el 26 de junio de 2011
La proteína huntingtina mutada causa la enfermedad de Huntington, pero no toda la huntingtina mutada es igual de tóxica. La localizacion exacta de la proteína mutada dentro de la célula tiene un gran impacto en su toxicidad. Nuevas investigaciones están ayudando a comprender cómo se mueve la huntingtina dentro de la célula lo que proporciona claves sobre cómo hacerla menos tóxica.
La huntingtina - y su gemelo diabólico
Aunque la enfermedad de Huntington es debida a una anomalía genética, sabemos que el daño en las células es debido a la proteína huntingtina mutada. El gen de la EH es un conjunto de instrucciones para fabricar la proteína huntingtina. En los pacientes con EH, y en los portadores de la enfermedad, un “error ortográfico” al inicio de las instrucciones genéticas, hace que un fragmento de la proteína sea más largo de lo normal. Esto hace que se acumulen demasiados bloques de construcción, llamados “glutamina”, en un extremo de la proteína.

Tener demasiados bloques de glutamina al principio de la proteína tiene efectos desastrosos, y es lo que produce los efectos nocivos de la huntingtina mutada.
Una de las principales tareas de los investigadores de la enfermedad de Huntington es la de conocer exactamente las diferencias entre la proteína mutada y la normal, y cómo esas diferencias dañan las células. Cada nueva información sobre cómo se produce el daño es una posible pista en la búsqueda de tratamientos para frenar el progreso de la enfermedad.
Ray Truant es un investigador de la enfermedad de Huntington en la Universidad McMaster de Ontario, Canadá. Truant y su equipo de científicos han estado estudiando la proteína huntingtina durante muchos años y han dado a conocer muchas ideas importantes sobre cómo funciona y cómo malfunciona en la enfermedad de Huntington.
El fragmento N-terminal
La huntingtina es una proteína grande, por lo que es difícil estudiarla toda entera a la vez. Tras el descubrimiento del gen en 1993, pronto se conoció que el fragmento más dañino de la proteína mutada era el que estaba cerca del inicio. Los científicos llamaron a este fragmento de la huntingtina, que contiene las glutaminas extra, “el fragmento N-terminal”.
Además de contener el gen mutado de la EH, este fragmento N-terminal de la proteína huntingtina tiene otras características interesantes. Los científicos las han estado estudiando durante casi 20 años y siguen encontrando propiedades inesperadas en este pequeño fragmento de proteína - propiedades que tienen gran impacto en las células.
Manejo de la carga celular
El laboratorio de Truant ya había descubierto que los primeros diecisiete bloques de aminoácidos de la huntingtina parecen ser especialmente importantes. Parece que viene a ser como algo parecido a ‘la dirección’ de toda la proteína.
En función de lo que ocurre en la célula, pequeñas ‘señales’ químicas se pegan a los primeros diecisiete aminoácidos, o se despegan. La maquinaria de transporte de la célula puede leer esas señales como un código de barras. Según el patrón de las señales presentes, la proteína huntingtina se traslada a diferentes sitios de la célula. Por lo tanto, a pesar de que estos diecisiete aminoácidos son sólo una pequeña porción de la proteína huntingtina en su conjunto, pueden tener un enorme impacto en la localización de la proteína y en su función.
La adición y eliminación de estas pequeñas señales se llama ‘modificación post-translacional’. 'Translación’ es el proceso de construcción de proteínas siguiendo las instrucciones del ADN de los genes, por lo que “post-translacional” sólo significa “después de la construcción de la proteína”.
Los números mágicos: trece y dieciséis
«Señales específicas en los aminoácidos trece y dieciséis de la huntingtina nos ayudan a saber si entrará o no en el núcleo. »
La comprensión de la modificación post-translacional es realmente importante en la EH, ya que parece influir en el daño que hace la proteína. Por ejemplo, en el 2009 el grupo de William Yang de la UCLA descubrieron que al añadir dos de estas señales los ratones EH ya no muestran síntomas. Estas señales se unieron a los bloques décimo tercero y décimo sexto de aminoácidos de la proteína huntingtina.
Dado que estas dos señales químicas parecían ser cruciales para la toxicidad de la proteína huntingtina mutada, es importante conocerlas en mayor detalle. El equipo de Truant se dispuso a estudiar el efecto de estas dos señales averiguando dónde se localizaba la proteína en su presencia y cuánto el daño que causaba.
¿Qué descubrieron?
En primer lugar, los investigadores estudiaron la proteína en las células vivas, que crecen en un plato de laboratorio. Alteraron genéticamente las células para que tuvieran sólo los primeros diecisiete bloques de aminoácidos de la proteína huntingtina, y las llamaron N17. El fragmento N17 de la huntingtina se unió a una proteína de medusa que se vuelve amarilla. Esto permite ver el fragmento N17 en el interior de las células.
El equipo de Truant vió que cuando se añaden dos señales en la posición trece y dieciséis al pequeño fragmento de la huntingtina, era mucho más probable de que el fragmento fuera al núcleo de las células.
El núcleo es una parte muy importante de la célula - pues es donde se almacena, duplica y lee el ADN. Muchos investigadores han sugerido que la huntingtina es más tóxica cuando se encuentra en el núcleo de las células. Pero también puede ser dañina cuando se encuentra fuera del núcleo, por lo que es importante saber dónde es más peligrosa.
El equipo fue más allá, mostrando que la huntingtina se encuentra en lugares muy específicos dentro del núcleo. También desarrollaron nuevas técnicas para poder ver sólo las versiones señaladas de la proteína, en lugar de todas las copias sin señalar que había flotando alrededor. Estas herramientas fueron de gran utilidad en futuros estudios que investigaban el papel que juega este proceso de señalización en la EH.
¿Qué pasa con los fármacos?
Este trabajo muestra que las señales en los aminoácidos decimotercero y decimosexto de la huntingtina ayudan a determinar si la huntingtina irá o no al núcleo. Esto lleva a pensar que los fármacos que modifiquen la señalización de estos aminoácidos podrían ser capaces de reducir el daño en las células.
¿Cómo funcionaría un fármaco así? O, en el lenguaje de los cazadores de fármacos, ¿cuál sería su “objetivo”?
Pues bien, las señales químicas se unen a la huntingtina mediante unas máquinas proteícas llamadas “quinasas”. Y son eliminadas por otros equipos llamados “fosfatasas. Las quinasas son un poco como grapadoras, mientras que las fosfatasas son más como quitagrapas.
Según el trabajo de Truant, los fármacos que disminuyen la actividad de la kinasa “grapadora” deberían reducir las señales en la huntingtina, manteniéndola fuera del núcleo. El siguiente paso sería ver dónde se encontraba la proteína y si esto la hacía más o menos tóxica.
Para comprobar esta teoría, el equipo de Truant utilizó muchos medicamentos diferentes cuyo objetivo son las quinasas. Estos “inhibidores de las quinasas” pueden ayudar a los científicos a saber qué quinasa se une a su proteína. Bloqueando una determinada quinasa y utilizando a continuación las nuevas herramientas que han desarrollado para buscar la huntingtina señalizada, los investigadores pueden saber qué quinasa está actuando.
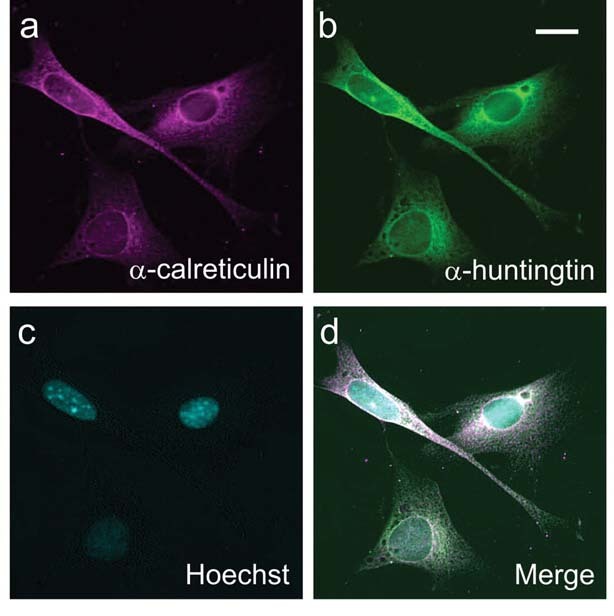
Después de probar fármacos que bloquean ochenta quinasas diferentes, el equipo descubrió que había una quinasa ‘quinasa caseína 2’ - o ‘CK2’ - que era particularmente importante. Como era de esperar, los fármacos que bloquean la CK2 hacían que la huntingtina tuviera menos señales en los sitios cruciales. Estos fármacos conseguían que la huntingtina se mantuviera fuera del núcleo, y se dirigiera a la parte de la célula que “fábrica las proteínas”, el retículo endoplásmico o ‘ER’. En este proceso, se aumentó el daño causado a las células por la proteína.
¡Un momento!, ¿hicieron que la proteína fuera MAS tóxica?
Por supuesto que un medicamento que hace que la huntingtina sea más tóxica es exactamente lo contrario de lo que nos gustaría obtener. Por lo tanto, no vayan a la farmacia a pedir una botella del inhibidor de la CK2.
Si este trabajo nos va a proporcionar tratamientos para los pacientes con enfermedad de Huntington, vamos a necesitar más cantidad de huntingtina señalada y no menos. Sin embargo, en esta primera etapa del trabajo, el equipo de Truant sólo estaba tratando de averiguar qué quinasa era la más prometedora.
Dado que los fármacos que bloqueaban la CK2 hacían que las células fueran más tóxicas, confirmaron que la CK2 es una quinasa importante en el proceso de señalización que nos interesa. Ahora podemos diseñar trabajos dirigidos a entender cómo conseguir el efecto contrario y hacer que la huntingtina sea menos tóxica.
Este estudio llevado a cabo en las células cultivadas en un plato, está lejos de generar tratamientos que se puedan utilizar en los pacientes. Pero es un paso importante, que nos ayuda a entender uno de los jugadores clave en el daño a las células en la enfermedad de Huntington, y abre una nueva puerta a los investigadores que trabajan en el diseño de futuros tratamientos.
Este artículo fue modificado el 27 de junio para aclarar el efecto de señalización y los medicamentos que bloquean la CK2.